
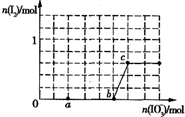
 已知溶液中,还原性为HSO3->I-,氧化性为IO3->I2>SO42-.
已知溶液中,还原性为HSO3->I-,氧化性为IO3->I2>SO42-.| 1 |
| 5 |


科目:高中化学 来源: 题型:
| A、反应容器中,压强不随时间改变而改变 |
| B、单位时间内生成3n mol C的同时生成n mol A |
| C、反应容器中,混合气体的平均相对分子质量不再改变 |
| D、反应容器中的气体密度不随时间变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:
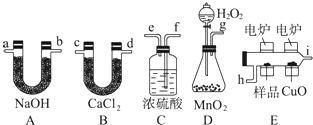
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 催化剂 |
| 高温高压 |
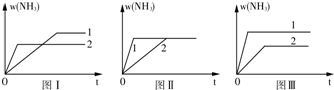
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、明矾用于净水:Al3++3H2O═Al(OH)3↓+3H+ |
| B、钢铁吸氧腐蚀的负极反应:Fe-3e-═Fe3+ |
| C、向明矾溶液中加入少量氢氧化钡溶液:Al3++SO42-+Ba2++3OH-═BaSO4↓+Al(OH)3↓ |
D、苯酚钠饱和溶液中通入少CO2: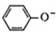 +CO2+H2O→ +CO2+H2O→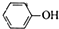 +HCO3- +HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、反应后溶液中ClO-的个数为0.1NA |
| B、原NaOH浓度为1mol/L |
| C、参加反应的氯气分子为0.1NA |
| D、转移电子为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、4种 | B、6种 |
| C、10种 | D、12种 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com