
【题目】已知:15P、33As位于同一主族,下列关系正确的是
A. 原子半径:As>Cl>P B. 热稳定性:HCl>PH3>AsH3
C. 非金属性:Cl>As>S D. 酸性:H3AsO4>H2SO4>H3PO4
科目:高中化学 来源: 题型:
【题目】下列对1mol·L-1的Na2SO4溶液叙述正确的是
A. 溶液中含有1mol Na2SO4 B. 1mol Na2SO4溶于1L水中
C. 可与1mol·L-1 BaCl2溶液完全反应 D. 1L溶液中含142g Na2SO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图表示氮及其化合物在一定条件下的转化关系:

(1)反应I:N2(g)+3H2(g)![]() 2NH3(g) ΔH=–92 kJmol-1
2NH3(g) ΔH=–92 kJmol-1
下左图是反应I中平衡混合气中NH3的体积分数随温度或压强变化的曲线,图中L(L1、L2)、X分别代表温度或压强。其中X代表的是________(填“温度”或“压强”)。

(2)①反应II的化学方程式是_________________________。
②反应II其中一步反应为2NH3(g)+3Cl2(g) =N2(g) +6HCl(g) ΔH=–462 kJmol-1
已知:N2(g)![]() 2N(g) Cl2(g)
2N(g) Cl2(g)![]() 2Cl(g)
2Cl(g)
断开1 mol H–N键与断开1 mol H–Cl键所需能量相差约为________kJ。
(3)(3)反应III是利用右上图所示装置电解制备NCl3(氯的化合价为+1),其原理是:NH4Cl+2HCl![]() NCl3+3H2↑。
NCl3+3H2↑。
①b接电源的_______极(填“正”或“负”)。② 阳极反应式是___________________。
(4)反应III得到的NCl3可以和NaClO2制备 ClO2,同时生成NH3,该反应的离子方程式是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能够充分说明在恒温恒容下的密闭容器中,反应2SO2(g)+O2(g)![]() 2SO3(g)已达平衡状态的标志是( )
2SO3(g)已达平衡状态的标志是( )
A. 容器中SO2、O2、SO3的物质的量之比为2∶1∶2
B. SO2和SO3的物质的量浓度相等
C. 反应容器内压强不随时间变化而变化
D. 单位时间内生成2 mol SO2时,也生成1 mol O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下图判断,下列说法正确的是( )

A. 装置Ⅰ和装置Ⅱ中负极反应均是Fe-2e-Fe2+
B. 装置Ⅰ和装置Ⅱ中正极反应均是O2+2H2O+4e-4OH-
C. 装置Ⅰ和装置Ⅱ中盐桥中的阳离子均向右侧烧杯移动
D. 放电过程中,装置Ⅰ左侧烧杯和装置Ⅱ右侧烧杯中溶液的pH均增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据题意解答
(1)FeCl3溶液常用于腐蚀印刷电路铜板,发生2FeCl3+Cu═2FeCl2+CuCl2 , 若将此反应设计成原电池,则负极所用电极材料为 , 当线路中转移0.1mol电子时,则被腐蚀铜的质量为g,正极的电极方程式为 .
(2)已知甲醇燃料电池的工作原理如图所示. 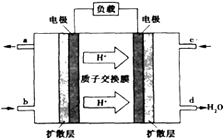
该电池工作时,b口通入的物质为 , 该电池正极的电极反应式为: , 工作一段时间后,当6.4g甲醇(CH3OH)完全反应生成CO2时,有mol电子发生转移.
(3)若将(3)中电池的电解质溶液换为KOH溶液,则负极的电极方程式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用已知浓度的NaOH溶液测定某H2SO4溶液的浓度,参考如图所示从下表中选出正确选项( )
选项 | 锥形瓶中溶液 | 滴定管中溶液 | 选用指示剂 | 选用滴定管 |
A | 碱 | 酸 | 石蕊 | 乙 |
B | 酸 | 碱 | 酚酞 | 甲 |
C | 碱 | 酸 | 甲基橙 | 乙 |
D | 酸 | 碱 | 酚酞 | 乙 |
![]()
A.A
B.B
C.C
D.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分析以下几个热化学方程式,哪个是表示固态碳和气态氢气燃烧时的燃烧热的是( )
A.C(s)+O2(g)═CO(g)△H=﹣110.5 kJ/mol
B.C(s)+O2(g)═CO2(g)△H=﹣393.5 kJ/mol
C.2H2(g)+O2(g)═2H2O(l)△H=﹣571.6 kJ/mol
D.H2(g)+ ![]() ?O2(g)═H2O(g)△H=﹣241.8 kJ/mol
?O2(g)═H2O(g)△H=﹣241.8 kJ/mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com