
【题目】能够充分说明在恒温恒容下的密闭容器中,反应2SO2(g)+O2(g)![]() 2SO3(g)已达平衡状态的标志是( )
2SO3(g)已达平衡状态的标志是( )
A. 容器中SO2、O2、SO3的物质的量之比为2∶1∶2
B. SO2和SO3的物质的量浓度相等
C. 反应容器内压强不随时间变化而变化
D. 单位时间内生成2 mol SO2时,也生成1 mol O2
科目:高中化学 来源: 题型:
【题目】士兵在野外加热食物时通常采用“无焰食物加热器”,其主要化学成分为镁粉、铁粉、氯化钠粉末.使用时加入水与其中的镁反应放出热量.下面是在室温下对本产品的两个探究实验. 实验1:向加有等量水的三个相同隔热容器中分别加入下列各组物质,结果见图1.
①1.0mol镁条、0.10mol铁粉、0.10mol氯化钠粉末;
②将1.0mol镁条剪成100份、0.10mol铁粉、0.10mol 氯化钠粉末;
③1.0mol镁粉、0.10mol 铁粉、0.10mol氯化钠粉末;
实验2:向加有100mL水的多个相同的隔热容器中分别加入由0.10mol镁粉、0.50mol铁粉及不同量的氯化钠粉末组成的混合物,不断搅拌,第15min时记录温度升高的幅度,结果见图2.
请回答下列问题:
(1)实验1证实了该反应的反应速率与有关.
(2)实验2中当NaCl的用量大于0.125mol时,实验就无须再做的原因是(填选项字母).
A.加入更多的NaCl不再增加反应速率
B.加入NaCl反而会降低反应速率
C.已达到沸点不再有温度变化
D.需要加入更多的铁粉来提高温度
(3)如果在实验2中加入0.060mol的NaCl,则第15min时混合物的温度最接近于(填字母).
A.34℃
B.42℃
C.50℃
D.62℃
(4)加入铁粉和NaCl能使反应速率加快的原因是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2L恒容密闭容器中充入2 mol X和1mol Y发生反应:2X(g)+Y(g) ![]() 3Z(g) ,反应过程持续升高温度,测得混合体系中X的体积分数与温度的关系如图所示。下列推断正确的是( )
3Z(g) ,反应过程持续升高温度,测得混合体系中X的体积分数与温度的关系如图所示。下列推断正确的是( )
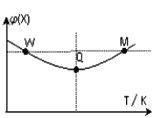
A. Q点时,Y的转化率最大
B. W点X的正反应速率等于M点X的正反应速率
C. 升高温度,平衡常数增大
D. 温度一定,平衡时充入Z,达到新平衡时Z的体积分数比原平衡时大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用0.10mol·L-1NaOH溶液分别滴定20.00mL浓度均为0.10mol·L-1CH3COOH溶液和HCN溶液所得滴定曲线如下图。下列说法正确的是
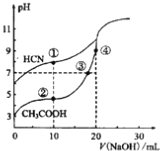
A. 点①和点②所示溶液中,c(CH3COO-)-)
B. 点①和点②所示溶液中,c(CH3COO-)-C(CN-)=c(HCN)-c(CH3COOH)
C. 点④所示溶液液中 :c(Na+) >c(OH-)>c(CH3COO-) >c(H+)
D. 点②和点③所示溶液中都有: c(CH3COO-)+c(OH-)=c(CH3COOH)+c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:15P、33As位于同一主族,下列关系正确的是
A. 原子半径:As>Cl>P B. 热稳定性:HCl>PH3>AsH3
C. 非金属性:Cl>As>S D. 酸性:H3AsO4>H2SO4>H3PO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有部分短周期元素的性质、应用或原子结构如下表:
元素编号 | 元素性质或原子结构 |
T | M层电子数是K层电子数的3倍 |
X | 一种同位素可测定文物年代 |
Y | 常温下单质为双原子分子,其氢化物水溶液呈碱性 |
Z | 元素最高正价是+7价 |
(1)元素X可测定文物年代的同位素符号是 .
(2)元素Z在周期表中的位置为 . Y单质的结构式为 .
(3)元素Y与氢元素形成一种离子YH4+ , 实验室检验溶液中含有这种离子方法是:(仅用离子反应方程式表示).
(4)元素Z与元素T相比,非金属性较强的是(用元素符号表示),下列表述中能证明这一事实的是 . a.常温下Z的单质和T的单质状态不同
b.Z的氢化物比T的氢化物稳定
c.一定条件下Z和T的单质都能与氢氧化钠溶液反应
d.Z的最高价氧化物对应水化物的酸性比T的最高价氧化物对应水化物的酸性强.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】除去下列物质中的杂质选用的试剂和方法最合理的是
物质 | 杂质 | 试剂 | 方法 | |
A | 二氧化碳 | 二氧化硫 | 饱和碳酸钠溶液 | 洗气 |
B | 氯化亚铁溶液 | 氯化铁 | 过量铁粉 | 过滤 |
C | 二氧化硅 | 氧化铝 | 氢氧化钠溶液 | 过滤 |
D | 铜 | 氧化铜 | 稀硝酸 | 萃取 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮的固定是几百年来科学家一直研究的课题.
(1)下表列举了不同温度下大气固氮和工业固氮的部分K值.
反应 | 大气固氮 | 工业固氮 | |||
温度/℃ | 27 | 2000 | 25 | 400 | 450 |
K | 3.84×10﹣31 | 0.1 | 5×108 | 0.507 | 0.152 |
①分析数据可知:大气固氮反应属于(填“吸热”或“放热”)反应
②分析数据可知:人类不适合大规模模拟大气固氮原因
③从平衡角度考虑.工业固氮应该选择常温条件,但实际工业产生却选择500℃左右的高温,解释其原因
(2)工业固氮反应中,在其他条件相同时,分别测定N2的平衡转化率在不同压强(р1、р2)下随温度变化的曲线,如图所示的图示中,正确的是(填“A”或“B”);比较р1、р2的大小关系 . 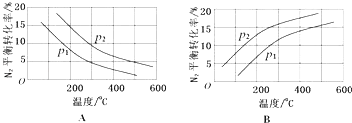
(3)近年,又有科学家提出在常温、常压、催化剂等条件下合成氨气的新思路,反应原理为:2N2(g)+6H2O(1)4NH3(g)+3O2(g),则其反应热△H= . 已知:N2(g)+3H2(g)2NH3(g)△H=﹣92.4kJmol﹣1
2H2(g)+O2(g)2H2O(l)△H=﹣571.6kJmol﹣1 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com