
����Ŀ�����в��ֶ�����Ԫ�ص����ʡ�Ӧ�û�ԭ�ӽṹ���±���
Ԫ�ر�� | Ԫ�����ʻ�ԭ�ӽṹ |
T | M���������K���������3�� |
X | һ��ͬλ�ؿɲⶨ������� |
Y | �����µ���Ϊ˫ԭ�ӷ��ӣ����⻯��ˮ��Һ�ʼ��� |
Z | Ԫ�����������+7�� |
��1��Ԫ��X�ɲⶨ���������ͬλ�ط����� ��
��2��Ԫ��Z�����ڱ��е�λ��Ϊ �� Y���ʵĽṹʽΪ ��
��3��Ԫ��Y����Ԫ���γ�һ������YH4+ �� ʵ���Ҽ�����Һ�к����������ӷ����ǣ����������ӷ�Ӧ����ʽ��ʾ����
��4��Ԫ��Z��Ԫ��T��ȣ��ǽ����Խ�ǿ��������Ԫ�ط��ű�ʾ�������б�������֤����һ��ʵ���� �� a��������Z�ĵ��ʺ�T�ĵ���״̬��ͬ
b��Z���⻯���T���⻯���ȶ�
c��һ��������Z��T�ĵ��ʶ���������������Һ��Ӧ
d��Z������������Ӧˮ��������Ա�T������������Ӧˮ���������ǿ��
���𰸡�
��1��![]()
��2���������ڢ�A�壻N��N
��3��NH4++OH�� ![]() NH3��+H2O
NH3��+H2O
��4��Cl��bd
���������⣺������Ԫ���У�TԪ��ԭ�ӵ�M���������K���������3����M�������Ϊ6����TΪSԪ�أ�XԪ�ص�һ��ͬλ�ؿɲⶨ�����������XΪCԪ�أ�������YԪ�ص���Ϊ˫ԭ�ӷ��ӣ����⻯��ˮ��Һ�ʼ��ԣ���YΪNԪ�أ�ZԪ�����������+7�ۣ���ZΪClԪ�أ���1��̼Ԫ�ص�һ��ͬλ�ؿɲⶨ�������������ͬλ�صķ����� ![]() �����Դ��ǣ�
�����Դ��ǣ� ![]() ����2��Ԫ��ZΪCl�������ڱ��е�λ��Ϊ�������ڢ�A�壬Y���ʵĽṹʽΪN��N�����Դ��ǣ��������ڢ�A�壻N��N����3��Ԫ��Y������Ԫ���γ�һ������YH4+ΪNH4+ �� ������Һ�д���NH4+���ӵķ���������Һ�������Һ���м���NaOH��Һ����ȣ��ܲ���ʹʪ��ĺ�ɫʯ����ֽ���������壬˵����Һ�д���NH4+���ӣ���֮��������NH4+���ӣ���Ӧ���ӷ���ʽΪ��NH4++OH��
����2��Ԫ��ZΪCl�������ڱ��е�λ��Ϊ�������ڢ�A�壬Y���ʵĽṹʽΪN��N�����Դ��ǣ��������ڢ�A�壻N��N����3��Ԫ��Y������Ԫ���γ�һ������YH4+ΪNH4+ �� ������Һ�д���NH4+���ӵķ���������Һ�������Һ���м���NaOH��Һ����ȣ��ܲ���ʹʪ��ĺ�ɫʯ����ֽ���������壬˵����Һ�д���NH4+���ӣ���֮��������NH4+���ӣ���Ӧ���ӷ���ʽΪ��NH4++OH�� ![]() NH3��+H2O�� ���Դ��ǣ�NH4++OH��
NH3��+H2O�� ���Դ��ǣ�NH4++OH�� ![]() NH3��+H2O����3��ͬ����������ҷǽ�������ǿ����ClԪ�طǽ����Ա�S��ǿ��
NH3��+H2O����3��ͬ����������ҷǽ�������ǿ����ClԪ�طǽ����Ա�S��ǿ��
a��Ԫ�طǽ�������״̬�أ��ʲ���֤���ȵķǽ�����ǿ����ģ���a����
b���⻯���ȶ�����Ԫ�طǽ�����һ�£��ȵ��⻯�������⻯���ȶ���˵���ȵķǽ����Ա����ǿ����b��ȷ��
c���ǽ���������������������Һ��Ӧ����˵���ǽ�����ǿ��������������������������Һ��Ӧ�����������������Ʒ�Ӧ�������ķǽ����Ը�ǿ����c����
d��Ԫ�صķǽ�����Խǿ����Ӧ�����������ˮ���������Խǿ�������ȵ����������ˮ��������Ա�������������ˮ���������ǿ����֤���ȵķǽ�����ǿ����d��ȷ��
���Դ��ǣ�Cl��bd��


 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������������䣬�����¶ȣ���һ���������
A.����Ħ����� VmB.��ѧƽ�ⳣ�� K
C.ˮ�����ӻ����� KwD.����ˮ��̶�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������Ϊ2L�������м���1mol N2��6mol H2���п��淴Ӧ��N2+3H22NH3 �� 2min����N2�����ʵ���Ϊ0.6mol����
��1��2min�ڣ�N2�����ʵ���������0.4mol��H2�����ʵ���������mol��NH3��������������mol��
��2������N2��Ũ�ȱ仯����ʾ�÷�Ӧ�ķ�Ӧ���ʣ���v��N2��=mol/��Lmin����
��3������H2��Ũ�ȱ仯����ʾ�÷�Ӧ�ķ�Ӧ���ʣ���v��H2��=mol/��Lmin����
��4������NH3��Ũ�ȱ仯����ʾ�÷�Ӧ�ķ�Ӧ���ʣ���v��NH3��=mol/��Lmin����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ܹ����˵���ں��º����µ��ܱ������У���Ӧ2SO2(g)+O2(g)![]() 2SO3(g)�Ѵ�ƽ��״̬�ı�־��(����)
2SO3(g)�Ѵ�ƽ��״̬�ı�־��(����)
A. ������SO2��O2��SO3�����ʵ���֮��Ϊ2��1��2
B. SO2��SO3�����ʵ���Ũ�����
C. ��Ӧ������ѹǿ����ʱ��仯���仯
D. ��λʱ��������2 mol SO2ʱ��Ҳ����1 mol O2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ʵĹ�ҵ�Ʒ���������
A. �����Ǵ����ʯ��ʯ���·�Ӧ�Ƶ�
B. ��¯������ͨ����ֱ̿�ӻ�ԭ������
C. ��ҵ��ͨ�����NaCl��Һ��ȡNa����
D. �ߴ�����Ʊ���ͨ��������ԭ���Ȼ���ʵ�ֵ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������
��1��FeCl3��Һ�����ڸ�ʴӡˢ��·ͭ�壬����2FeCl3+Cu�T2FeCl2+CuCl2 �� �����˷�Ӧ��Ƴ�ԭ��أ������õ缫����Ϊ �� ����·��ת��0.1mol����ʱ����ʴͭ������Ϊg�������ĵ缫����ʽΪ ��
��2����֪�״�ȼ�ϵ�صĹ���ԭ����ͼ��ʾ�� 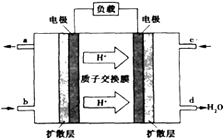
�õ�ع���ʱ��b��ͨ�������Ϊ �� �õ�������ĵ缫��ӦʽΪ�� �� ����һ��ʱ���6.4g�״���CH3OH����ȫ��Ӧ����CO2ʱ����mol���ӷ���ת�ƣ�
��3��������3���е�صĵ������Һ��ΪKOH��Һ�����ĵ缫����ʽΪ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʽΪC8H10O�ķ����廯��������Ȼ�����Һ����ɫ����������Ʒ�Ӧ�ų�����������������ͬ���칹���У� ��
A.����10��
B.10��
C.6��
D.5��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������NOCl�����л��ϳ��е���Ҫ�Լ�������NO��Cl2�ڳ��³�ѹ�ºϳɡ���֪NOCl��һ�ֺ��ɫҺ����ɫ���壬���۵�64.5�����е�5.5������ˮ��ˮ�⡣
��1��ʵ�����Ʊ�ԭ����NO��Cl2��װ������ͼ��ʾ��

��ʵ������NOʱ��װ��A����ƿ�ڷ�����Ӧ�Ļ�ѧ����ʽΪ_______��
��ʵ������Cl2ʱ��װ��B��ʢ�ŵ��Լ�Ϊ________����������________��
��2���������ռ�����Cl2���뼯��ƿ�У���ͼʾװ���Ʊ��������ȡ�
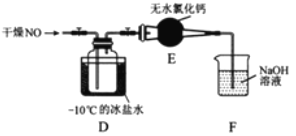
��NOCl�����и�ԭ�Ӿ�����8�����ȶ��ṹ����NOCl�ĵ���ʽΪ________��
��װ��D�е�����Ϊ________��
��װ��E����ˮ�Ȼ��Ƶ�����Ϊ________��
��ijͬѧ��Ϊװ��F��������NO��Ϊ�����һ���⣬�ɽ�β����ij������ͬʱͨ������������Һ�У���������Ļ�ѧʽ��________��
��3��NO���ü�ӵ绯ѧ����ȥ����ԭ������ͼ��ʾ��

�������ĵ缫��ӦʽΪ______________________��
���������ڷ�����Ӧ�����ӷ���ʽΪ_________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и��������ڵȵ�������ǣ� ��
A.CO��CO2
B.NO��NO2
C.CH4��NH3
D.CO2��N2O
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com