
【题目】下列各组微粒属于等电子体的是( )
A.CO和CO2
B.NO和NO2
C.CH4和NH3
D.CO2和N2O
 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案科目:高中化学 来源: 题型:
【题目】现有部分短周期元素的性质、应用或原子结构如下表:
元素编号 | 元素性质或原子结构 |
T | M层电子数是K层电子数的3倍 |
X | 一种同位素可测定文物年代 |
Y | 常温下单质为双原子分子,其氢化物水溶液呈碱性 |
Z | 元素最高正价是+7价 |
(1)元素X可测定文物年代的同位素符号是 .
(2)元素Z在周期表中的位置为 . Y单质的结构式为 .
(3)元素Y与氢元素形成一种离子YH4+ , 实验室检验溶液中含有这种离子方法是:(仅用离子反应方程式表示).
(4)元素Z与元素T相比,非金属性较强的是(用元素符号表示),下列表述中能证明这一事实的是 . a.常温下Z的单质和T的单质状态不同
b.Z的氢化物比T的氢化物稳定
c.一定条件下Z和T的单质都能与氢氧化钠溶液反应
d.Z的最高价氧化物对应水化物的酸性比T的最高价氧化物对应水化物的酸性强.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成氨反应:N2(g)+3H2(g)2NH3(g)△H=﹣92.4kJmol﹣1 , 在反应过程中,正反应速率的变化如图.下列说法正确的是( ) 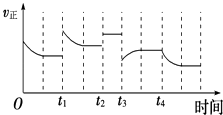
A.t1时升高了温度
B.t2时使用了催化剂
C.t3时增大了压强
D.t4时降低了温度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮的固定是几百年来科学家一直研究的课题.
(1)下表列举了不同温度下大气固氮和工业固氮的部分K值.
反应 | 大气固氮 | 工业固氮 | |||
温度/℃ | 27 | 2000 | 25 | 400 | 450 |
K | 3.84×10﹣31 | 0.1 | 5×108 | 0.507 | 0.152 |
①分析数据可知:大气固氮反应属于(填“吸热”或“放热”)反应
②分析数据可知:人类不适合大规模模拟大气固氮原因
③从平衡角度考虑.工业固氮应该选择常温条件,但实际工业产生却选择500℃左右的高温,解释其原因
(2)工业固氮反应中,在其他条件相同时,分别测定N2的平衡转化率在不同压强(р1、р2)下随温度变化的曲线,如图所示的图示中,正确的是(填“A”或“B”);比较р1、р2的大小关系 . 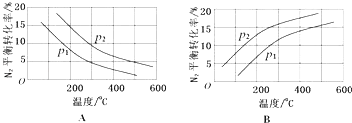
(3)近年,又有科学家提出在常温、常压、催化剂等条件下合成氨气的新思路,反应原理为:2N2(g)+6H2O(1)4NH3(g)+3O2(g),则其反应热△H= . 已知:N2(g)+3H2(g)2NH3(g)△H=﹣92.4kJmol﹣1
2H2(g)+O2(g)2H2O(l)△H=﹣571.6kJmol﹣1 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应mA(固)+nB(气)pC(气)△H<0在一定温度下B的体积分数(B%)与压强变化的关系如图所示,下列叙述中正确的是( ) 
A.m+n>P
B.n>p
C.x点表示该反应的正反应速率小于逆反应速率
D.x点比y点时的反应速率慢
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关电化学装置的说法正确的是( )

A. 图d中若M是NaOH溶液,接通电源后可以观察到白色沉淀迅速变成灰绿色,最红变红褐色
B. 图b电解一段时间,铜电极溶解,石墨电极上有亮红色物质析出
C. 图c中的X极若为负极,则该装置可实现粗铜的精炼
D. 利用图a装置处理银器表面的黑斑Ag2S,银器表面发生的反应为Ag2S+2e-===2Ag+S2-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求填空。
(1)氢能是发展中的新能源,它的利用包括氢的制备、储存和应用三个环节。回答下列问题:
①与汽油相比,氢气作为燃料的优点是_____________________(至少答出两点)。
②利用太阳能直接分解水制氢,是最具吸引力的制氢途径,其能量转化形式为____________。
(2)有机物M经过太阳光光照可转化成N,转化过程如下:
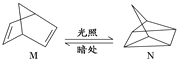 ΔH=+88.6 kJ·mol-1。则M、N相比,较稳定的是____________。
ΔH=+88.6 kJ·mol-1。则M、N相比,较稳定的是____________。
(3)火箭和导弹表面的薄层是耐高温物质。将石墨、铝粉和二氧化钛一定比例混合高温下煅烧,产物可作耐高温材料,4Al(s)+3TiO2(s)+3C(s)===2Al2O3(s)+3TiC(s)ΔH=-1 176 kJ·mol-1,则反应过程中,每转移1 mol电子放出的热量为______________。
(4)在一定温度下,4 L密闭容器内某一反应中气体M、气体N的物质的量随时间变化的曲线如图:
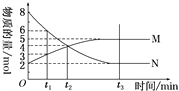
①该反应的化学方程式为____________________________。
②若t2=2 min,计算反应开始至t2时刻用M的浓度变化表示的平均反应速率为______________。
③t2时刻,反应物的转化率为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成氨及其相关工业中,部分物质间的转化关系如下:

下列说法不正确的是( )
A. 反应Ⅰ、Ⅱ、Ⅲ、Ⅳ均属于氧化还原反应
B. 上述转化中包含了氨气、硝酸、硝铵、小苏打、纯碱的工业生产方法
C. 反应Ⅳ和Ⅵ中的部分产物可在上述流程中循环利用
D. 反应V是先向饱和氯化钠溶液中通CO2至饱和再通NH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据碘与氢气反应的热化学方程式
(1)I2(g)+H2(g)![]() 2HI(g) ΔH=-9.48 kJ·mol-1
2HI(g) ΔH=-9.48 kJ·mol-1
(2)I2(s)+H2(g)![]() 2HI(g) ΔH="+26.48" kJ·mol-1
2HI(g) ΔH="+26.48" kJ·mol-1
下列判断正确的是( )
A. 254 g I2(g)中通入2 g H2(g),反应放热9.48 kJ
B. 1 mol固态碘与1 mol气态碘所含的能量相差17.00 kJ
C. 反应(1)的产物比反应(2)的产物稳定
D. 反应(2)的反应物的总能量比反应(1)的反应物的总能量低
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com