
【题目】合成氨反应:N2(g)+3H2(g)2NH3(g)△H=﹣92.4kJmol﹣1 , 在反应过程中,正反应速率的变化如图.下列说法正确的是( ) 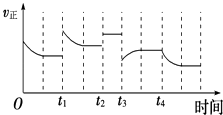
A.t1时升高了温度
B.t2时使用了催化剂
C.t3时增大了压强
D.t4时降低了温度
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】向体积为2L的容器中加入1mol N2和6mol H2进行可逆反应:N2+3H22NH3 , 2min后测得N2的物质的量为0.6mol,则:
(1)2min内,N2的物质的量减少了0.4mol,H2的物质的量减少了mol,NH3的物质量增加了mol.
(2)若用N2的浓度变化来表示该反应的反应速率,则v(N2)=mol/(Lmin).
(3)若用H2的浓度变化来表示该反应的反应速率,则v(H2)=mol/(Lmin).
(4)若用NH3的浓度变化来表示该反应的反应速率,则v(NH3)=mol/(Lmin).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分子式为C8H10O的芳香族化合物,遇三氯化铁溶液不显色,能与金属钠反应放出氢气,满足条件的同分异构体有( )
A.大于10种
B.10种
C.6种
D.5种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酰氯(NOCl)是有机合成中的重要试剂,可由NO与Cl2在常温常压下合成。已知NOCl是一种红褐色液体或黄色气体,其熔点64.5℃,沸点5.5℃,遇水易水解。
(1)实验室制备原料气NO和Cl2的装置如下图所示:

①实验室制NO时,装置A中烧瓶内发生反应的化学方程式为_______。
②实验室制Cl2时,装置B中盛放的试剂为________,其作用是________。
(2)将上述收集到的Cl2充入集气瓶中,按图示装置制备亚硝酰氯。
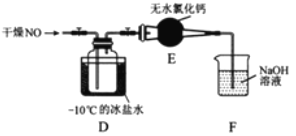
①NOCl分子中各原子均满足8电子稳定结构,则NOCl的电子式为________。
②装置D中的现象为________。
③装置E中无水氯化钙的作用为________。
④某同学认为装置F不能吸收NO,为解决这一问题,可将尾气与某种气体同时通入氢氧化钠溶液中,这种气体的化学式是________。
(3)NO可用间接电化学法除去,其原理如下图所示:

①阴极的电极反应式为______________________。
②吸收塔内发生反应的离子方程式为_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组利用H2C2O4溶液和酸性KMnO4溶液反应来探究“外界条件对化学反应速率的影响”,进行了如下实验:
实验 编号 | 室温下,试管中所加试剂及其用量/mL | 室温下溶液颜色褪至无色所需时间/min | |||
0.6 mol/L H2C2O4溶液 | H2O | 0.2 mol/L KMnO4溶液 | 3 mol/L 稀硫酸 | ||
1 | 3.0 | 4.0 | 1.0 | 2.0 | 6.4 |
2 | 3.0 | 2.0 | 3.0 | 2.0 | 4.0 |
3 | 1.0 | a | 3.0 | 2.0 | 5.6 |
4 | |||||
请回答:
(1)已知KMnO4酸性溶液与H2C2O4溶液反应有CO2生成,用化学方程式表示该实验的实验原理________________________________________。
(2)a=______,设计实验2、3的目的是______________________
(3)利用实验2中数据计算,用KMnO4的浓度变化表示的反应速率为v(KMnO4)=____________。
(4)该小组同学根据经验绘制了n(Mn2+)随时间变化趋势的示意图,如图1所示。但有同学查阅已有的实验资料发现,该实验过程中n(Mn2+)随时间变化的趋势应如图2所示。该小组同学根据图2所示信息提出了新的假设,并继续进行实验探究。

①该同学绘制图1的依据是________________________________________
②该小组同学提出的假设是_________________________________________
③请你帮助该小组同学完成实验方案,并填写表中空白。
实 验 编 号 | 室温下,试管中所加试剂及其用量/mL | 再向试 管中加 入少量 固体 | 室温下 溶液颜 色褪至 无色所 需时间 /min | |||
0.6 mol/L H2C2O4溶液 | H2O | 0.2 mol/L KMnO4溶液 | 3 mol/L 稀硫酸 | |||
4 | 3.0 | 2.0 | 3.0 | 2.0 | t | |
④若该小组同学提出的假设成立,则其依据是__________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随原子序数的递增,八种短周期元素(用字母X表示)原子半径的相对大小、最高正价或最低负价的变化如图所示. 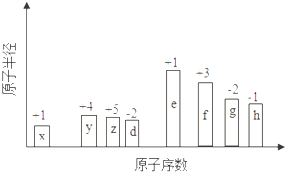
根据判断出的元素回答问题:
(1)y的元素名称 , 它位于元素周期表中第周期第族.
(2)h的最高价氧化物的化学式为 .
(3)d、g两种元素的最简单氢化物中稳定性比较强的物质,其结构式是 .
(4)x、z两元素可形成含有10个电子的分子,该分子的电子式为 . 位于第四周期且与z同主族的元素,其气态氢化物的化学式为 .
(5)e、f 两种元素最高价氧化物对应的水化物发生反应的离子方程式为 .
(6)将1mol e的单质在足量d 2中燃烧,所得产物中含有阴离子的数目为 , 含有的化学键为 . a.离子键 b.极性共价键 c.非极性共价键
(7)由x、d两种元素的原子按1:1组成的常见液态化合物的稀溶液易被催化分解,可使用的催化剂为(填序号) . a.MnO2 b.FeCl3 c.Na2SO3 d.K2SO4 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com