
【题目】分子式为C8H10O的芳香族化合物,遇三氯化铁溶液不显色,能与金属钠反应放出氢气,满足条件的同分异构体有( )
A.大于10种
B.10种
C.6种
D.5种
 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案科目:高中化学 来源: 题型:
【题目】使用如图所示装置进行化学小实验,请填写下列空白: 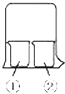
(1)若①中放一片湿润的红色石蕊试纸,②装有浓氨水,可观察到的实验现象为
(2)若①装有AlCl3溶液,②装有浓氨水,可观察到的实验现象为
(3)若①装有浓硝酸,②装有浓氨水,可观察到的实验现象为
(4)若①装有浓硝酸,②装有Na2SO3溶液,实验时有无色气体产生,该气体逐渐变为红棕色,用化学方程式表示无色气体变为红棕色的原因
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用0.10mol·L-1NaOH溶液分别滴定20.00mL浓度均为0.10mol·L-1CH3COOH溶液和HCN溶液所得滴定曲线如下图。下列说法正确的是
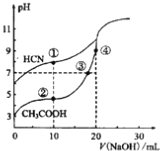
A. 点①和点②所示溶液中,c(CH3COO-)-)
B. 点①和点②所示溶液中,c(CH3COO-)-C(CN-)=c(HCN)-c(CH3COOH)
C. 点④所示溶液液中 :c(Na+) >c(OH-)>c(CH3COO-) >c(H+)
D. 点②和点③所示溶液中都有: c(CH3COO-)+c(OH-)=c(CH3COOH)+c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有部分短周期元素的性质、应用或原子结构如下表:
元素编号 | 元素性质或原子结构 |
T | M层电子数是K层电子数的3倍 |
X | 一种同位素可测定文物年代 |
Y | 常温下单质为双原子分子,其氢化物水溶液呈碱性 |
Z | 元素最高正价是+7价 |
(1)元素X可测定文物年代的同位素符号是 .
(2)元素Z在周期表中的位置为 . Y单质的结构式为 .
(3)元素Y与氢元素形成一种离子YH4+ , 实验室检验溶液中含有这种离子方法是:(仅用离子反应方程式表示).
(4)元素Z与元素T相比,非金属性较强的是(用元素符号表示),下列表述中能证明这一事实的是 . a.常温下Z的单质和T的单质状态不同
b.Z的氢化物比T的氢化物稳定
c.一定条件下Z和T的单质都能与氢氧化钠溶液反应
d.Z的最高价氧化物对应水化物的酸性比T的最高价氧化物对应水化物的酸性强.
查看答案和解析>>
科目:高中化学 来源: 题型:
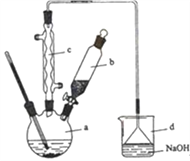
【题目】溴苯是一种化工原料,实验室合成溴苯的装置示意图及有关数据如下:按下列合成步骤回答问题:
苯 | 溴 | 溴苯 | |
密度/g·cm-3 | 0.88 | 3.10 | 1.50 |
沸点/°C | 80 | 59 | 156 |
水中溶解度 | 微溶 | 微溶 | 微溶 |
(1)在a中加入15 mL无水苯和少量铁屑。在b中小心加入4.0 mL液态溴。向a中滴入几滴溴,有白色烟雾产生,是因为生成了_____气体。继续滴加至液溴滴完。装置d的作用是________;制取溴苯的化学方程式____________________________。
(2)液溴滴完后,经过下列步骤分离提纯:
①向a中加入10mL水,然后过滤除去未反应的铁屑;
②滤液依次用10mL水、8mL10%的NaOH溶液、10mL水洗涤。NaOH溶液洗涤的作用是:______。
③向分出的粗溴苯中加入少量的无水氯化钙,静置、过滤。加入氯化钙的目的是_____;
(3)经以上分离操作后,粗溴苯中还含有的主要杂质为_______________,要进一步提纯,下列操作中必须的是_________(填入正确选项前的字母)。
A.重结晶 B.过滤 C.蒸馏 D.萃取
(4)取反应后烧杯中的溶液2 mL加入足量的稀硝酸酸化,再滴入AgNO3溶液,有浅黄色沉淀生成___(能或不能)证明苯与液溴反生了取代反应,为什么? _______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】除去下列物质中的杂质选用的试剂和方法最合理的是
物质 | 杂质 | 试剂 | 方法 | |
A | 二氧化碳 | 二氧化硫 | 饱和碳酸钠溶液 | 洗气 |
B | 氯化亚铁溶液 | 氯化铁 | 过量铁粉 | 过滤 |
C | 二氧化硅 | 氧化铝 | 氢氧化钠溶液 | 过滤 |
D | 铜 | 氧化铜 | 稀硝酸 | 萃取 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于热化学反应的描述中正确的是( )
A.吸热反应不一定需要加热才能发生
B.CO(g)的燃烧热是283.0 kJ/mol,则2CO2(g)═2CO(g)+O2(g)△H=2×283.0 kJ/mol
C.HCl和NaOH反应的中加热△H=﹣57.3 kJ/mol,则H2SO4和Ca(OH)2反应的中和热△H=2×(﹣57.3)kJ/mol
D.1 mol甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷的燃烧热
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成氨反应:N2(g)+3H2(g)2NH3(g)△H=﹣92.4kJmol﹣1 , 在反应过程中,正反应速率的变化如图.下列说法正确的是( ) 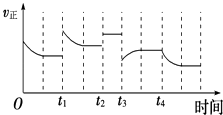
A.t1时升高了温度
B.t2时使用了催化剂
C.t3时增大了压强
D.t4时降低了温度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求填空。
(1)氢能是发展中的新能源,它的利用包括氢的制备、储存和应用三个环节。回答下列问题:
①与汽油相比,氢气作为燃料的优点是_____________________(至少答出两点)。
②利用太阳能直接分解水制氢,是最具吸引力的制氢途径,其能量转化形式为____________。
(2)有机物M经过太阳光光照可转化成N,转化过程如下:
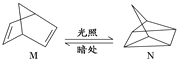 ΔH=+88.6 kJ·mol-1。则M、N相比,较稳定的是____________。
ΔH=+88.6 kJ·mol-1。则M、N相比,较稳定的是____________。
(3)火箭和导弹表面的薄层是耐高温物质。将石墨、铝粉和二氧化钛一定比例混合高温下煅烧,产物可作耐高温材料,4Al(s)+3TiO2(s)+3C(s)===2Al2O3(s)+3TiC(s)ΔH=-1 176 kJ·mol-1,则反应过程中,每转移1 mol电子放出的热量为______________。
(4)在一定温度下,4 L密闭容器内某一反应中气体M、气体N的物质的量随时间变化的曲线如图:
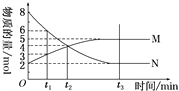
①该反应的化学方程式为____________________________。
②若t2=2 min,计算反应开始至t2时刻用M的浓度变化表示的平均反应速率为______________。
③t2时刻,反应物的转化率为______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com