
【题目】常温下,用0.10mol·L-1NaOH溶液分别滴定20.00mL浓度均为0.10mol·L-1CH3COOH溶液和HCN溶液所得滴定曲线如下图。下列说法正确的是
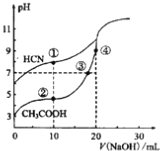
A. 点①和点②所示溶液中,c(CH3COO-)-)
B. 点①和点②所示溶液中,c(CH3COO-)-C(CN-)=c(HCN)-c(CH3COOH)
C. 点④所示溶液液中 :c(Na+) >c(OH-)>c(CH3COO-) >c(H+)
D. 点②和点③所示溶液中都有: c(CH3COO-)+c(OH-)=c(CH3COOH)+c(H+)
【答案】B
【解析】点①溶液有电荷守恒:c(CN-)+c(OH-)=c(Na+)+c(H+),所以点①溶液的c(CN-)=c(Na+)+c(H+)-c(OH-);点②溶液有电荷守恒:c(CH3COO-)+c(OH-)=c(Na+)+c(H+),所以点②溶液的c(CH3COO-)=c(Na+)+c(H+)-c(OH-);因为两点所处的溶液中加入的氢氧化钠溶液体积相等,所以c(Na+)一定相等,而点①溶液的pH高于点②溶液,即点①溶液的c(H+)小于点②溶液而且点①溶液的c(OH-)大于点②溶液,所以得到点①溶液的c(Na+)+c(H+)-c(OH-)一定小于点②溶液的c(Na+)+c(H+)-c(OH-),即点①溶液的c(CN-)小于点②溶液的c(CH3COO-),选项A错误。开始时为20.00mL浓度均为0.10 mol·L-1 的CH3COOH溶液和HCN溶液,所以两溶液中CH3COOH和HCN的物质的量相等,由物料守恒得到:n(CH3COO-)+ n(CH3COOH) =n(HCN)+n(CN-),加入氢氧化钠不会影响上述的物料守恒,所以等式依然成立,点①和点②所示溶液的体积相等,所以在等式:n(CH3COO-)+ n(CH3COOH) =n(HCN)+n(CN-)的两侧都除以相同的溶液体积得到:c(CH3COO-)+ c(CH3COOH) =c(HCN)+c(CN-),即c(CH3COO-)-c(CN-)=c(HCN)-c(CH3COOH),选项B正确。点④所示溶液加入了20mL的氢氧化钠溶液,此时酸碱恰好中和,形成CH3COONa溶液,该溶液的离子溶度顺序为c(Na+)>c(CH3COO-)>c(OH-)>c(H+),选项C错误。根据电荷守恒,点②和点③所示溶液中都有: c(CH3COO-)+c(OH-)=c(Na+)+c(H+),如果题目所说两点所示溶液都有:c(CH3COO-)+c(OH-)=c(CH3COOH)+c(H+)成立,则两点溶液都应该有c(Na+)=c(CH3COOH),实际两点溶液均不存在以上结果。点②所示溶液加入了10mL氢氧化钠溶液,中和一半的醋酸,应该得到CH3COOH和CH3COONa浓度相等的混合溶液,此时溶液显酸性,可以认为CH3COOH的电离大于CH3COO-的水解,所以有c(CH3COO-)>c(Na+)>c(CH3COOH),即c(Na+)≠c(CH3COOH);点②所示溶液中已经是c(Na+)>c(CH3COOH),随着氢氧化钠的加入c(Na+)增大,c(CH3COOH)减小,点③所示溶液中两者更不可能相等,选项D错误。


科目:高中化学 来源: 题型:
【题目】滴定原理在中学化学实验中有着极为重要的应用,现欲采用滴定的方法测定样品中硫酸亚铁的质量分数(约45%),根据反应:
2KMnO4+10FeSO4+8H2SO4 ═ 2MnSO4+5Fe2(SO4)3+K2SO4+8H2O。
步骤如下:
①称量样品3.0 g配成100 mL溶液;
②取20.00 mL待测液,置于锥形瓶中,再加入适量硫酸;
③将0.1 mol/L的标准KMnO4溶液装入滴定管,调节液面至a mL处(见下图);

④滴定待测液至滴定终点时,滴定管液面读数为6;
⑤重复滴定2~3次;
⑥计算。
(1)实验步骤③中的溶液体积读数为________mL。
(2)实验步骤①、③中还需要使用的最主要的仪器分别为:①________、③________。
(3)在步骤④的滴定操作中是否需要在待测液中加入指示剂________。(填“是”或“否”)
(4)若滴定时每次消耗KMnO4溶液体积的平均值为V mL,则绿矾样品的纯度为________。(列出算式即可)如果步骤③中读数时俯视,则最终结果________。(填“偏大”、“不变”或“偏小”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向体积为2L的容器中加入1mol N2和6mol H2进行可逆反应:N2+3H22NH3 , 2min后测得N2的物质的量为0.6mol,则:
(1)2min内,N2的物质的量减少了0.4mol,H2的物质的量减少了mol,NH3的物质量增加了mol.
(2)若用N2的浓度变化来表示该反应的反应速率,则v(N2)=mol/(Lmin).
(3)若用H2的浓度变化来表示该反应的反应速率,则v(H2)=mol/(Lmin).
(4)若用NH3的浓度变化来表示该反应的反应速率,则v(NH3)=mol/(Lmin).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒温、恒容的容器中进行反应:2HIH2+I2(正反应为吸热反应),反应物的浓度由0.1mol/L降到0.06mol/L需要20s,那么由0.06mol/L降到0.036mol/L所需时间为( )
A.等于10 s
B.等于12 s
C.大于12 s
D.小于12 s
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能够充分说明在恒温恒容下的密闭容器中,反应2SO2(g)+O2(g)![]() 2SO3(g)已达平衡状态的标志是( )
2SO3(g)已达平衡状态的标志是( )
A. 容器中SO2、O2、SO3的物质的量之比为2∶1∶2
B. SO2和SO3的物质的量浓度相等
C. 反应容器内压强不随时间变化而变化
D. 单位时间内生成2 mol SO2时,也生成1 mol O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质的工业制法合理的是
A. 玻璃是纯碱和石灰石高温反应制得
B. 高炉炼铁中通过焦炭直接还原赤铁矿
C. 工业上通过电解NaCl溶液获取Na单质
D. 高纯硅的制备是通过氢气还原四氯化硅实现的
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分子式为C8H10O的芳香族化合物,遇三氯化铁溶液不显色,能与金属钠反应放出氢气,满足条件的同分异构体有( )
A.大于10种
B.10种
C.6种
D.5种
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com