
����Ŀ����ԭ�������ĵ��������ֶ�����Ԫ�أ�����ĸX��ʾ��ԭ�Ӱ뾶����Դ�С��������ۻ�����۵ı仯��ͼ��ʾ�� 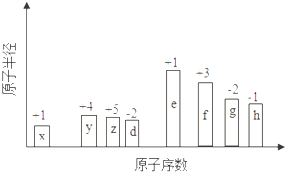
�����жϳ���Ԫ�ػش����⣺
��1��y��Ԫ������ �� ��λ��Ԫ�����ڱ��е����ڵ��壮
��2��h�����������Ļ�ѧʽΪ ��
��3��d��g����Ԫ�ص�����⻯�����ȶ��ԱȽ�ǿ�����ʣ���ṹʽ�� ��
��4��x��z��Ԫ�ؿ��γɺ���10�����ӵķ��ӣ��÷��ӵĵ���ʽΪ �� λ�ڵ�����������zͬ�����Ԫ�أ�����̬�⻯��Ļ�ѧʽΪ ��
��5��e��f ����Ԫ������������Ӧ��ˮ�������Ӧ�����ӷ���ʽΪ ��
��6����1mol e�ĵ���������d 2��ȼ�գ����ò����к��������ӵ���ĿΪ �� ���еĻ�ѧ��Ϊ �� a�����Ӽ� b�����Թ��ۼ� c���Ǽ��Թ��ۼ�
��7����x��d����Ԫ�ص�ԭ�Ӱ�1��1��ɵij���Һ̬�������ϡ��Һ�ױ����ֽ⣬��ʹ�õĴ���Ϊ������ţ� �� a��MnO2 b��FeCl3 c��Na2SO3 d��K2SO4 ��
���𰸡�
��1��̼������IVA
��2��Cl2O7
��3��H��O��H
��4��![]() ��AsH3
��AsH3
��5��OH��+Al��OH��3�TAlO2��+2H2O
��6��0.5NA��ac
��7��ab
���������⣺һ����˵�����Ӳ���Խ��ԭ�Ӱ뾶Խ��ͬһ����Ԫ��ԭ�Ӱ뾶����ԭ�������������С����������Ԫ����˵������������ϼ�=��������O��FԪ�س��⣩����������ϼ�=��������8������ͼ֪��x��y��z��d��e��f��g��h�ֱ���H��C��N��O��Na��Al��S��ClԪ�أ���1��y��CԪ�أ�����Ԫ��ԭ�Ӻ�����Ӳ���������������ͬ������������������������ͬ��Cԭ�Ӻ�����2�����Ӳ㡢������������4������Cλ�ڵڶ����ڵ�IVA�壬 ���Դ��ǣ�̼������IVA����2��h��ClԪ�أ�����������ϼ���+7�ۣ�����������OԪ�ػ��ϼ�Ϊ��2�ۣ����ݷ����и�Ԫ�ػ��ϼ۵Ĵ�����Ϊ0ȷ����ѧʽΪCl2O7 �� ���Դ��ǣ�Cl2O7����3��d��g�ֱ���O��SԪ�أ�Ԫ�صķǽ�����Խǿ���⻯����ȶ���Խǿ���ǽ�����O��S������ˮ���ȶ��Դ������⣬ˮ���ӽṹʽΪH��O��H�����Դ��ǣ�H��O��H����4��x��z�ֱ���H��NԪ�أ������γɵ�10���ӷ���Ϊ����������ʽΪ ![]() ��λ�ڵ�����������zͬ�����Ԫ����AsԪ�أ�As��HԪ���γɵ��⻯��Ͱ�����ѧʽ���ƣ�����ʽΪAsH3 ��
��λ�ڵ�����������zͬ�����Ԫ����AsԪ�أ�As��HԪ���γɵ��⻯��Ͱ�����ѧʽ���ƣ�����ʽΪAsH3 ��
���Դ��ǣ� ![]() ��AsH3����5��e��f ����Ԫ������������Ӧ��ˮ����ֱ���NaOH���������������߷�Ӧ����ƫ�����ƺ�ˮ�����ӷ���ʽΪOH��+Al��OH��3�TAlO2��+2H2O�����Դ��ǣ�OH��+Al��OH��3�TAlO2��+2H2O����6��e��d��Na��OԪ�أ���1mol e�ĵ���������d 2��ȼ�գ�������Ϊ�������ƣ�����Naԭ���غ�֪�����ɹ������Ƶ����ʵ���Ϊ0.5mol��ÿ����ѧʽ�к���1�����������ӣ��������������ʵ���Ϊ0.5mol������Ϊ0.5NA�����������������Ӻ���������֮��������Ӽ���O��Oԭ��֮����ڷǼ��Լ���
��AsH3����5��e��f ����Ԫ������������Ӧ��ˮ����ֱ���NaOH���������������߷�Ӧ����ƫ�����ƺ�ˮ�����ӷ���ʽΪOH��+Al��OH��3�TAlO2��+2H2O�����Դ��ǣ�OH��+Al��OH��3�TAlO2��+2H2O����6��e��d��Na��OԪ�أ���1mol e�ĵ���������d 2��ȼ�գ�������Ϊ�������ƣ�����Naԭ���غ�֪�����ɹ������Ƶ����ʵ���Ϊ0.5mol��ÿ����ѧʽ�к���1�����������ӣ��������������ʵ���Ϊ0.5mol������Ϊ0.5NA�����������������Ӻ���������֮��������Ӽ���O��Oԭ��֮����ڷǼ��Լ���
���Դ��ǣ�0.5NA��ac����7��x��d�ֱ���H��OԪ�أ���x��d����Ԫ�ص�ԭ�Ӱ�1��1��ɵij���Һ̬��������˫��ˮ��˫��ˮ��ϡ��Һ�ױ����ֽ�����������ˮ�����ö������̺��Ȼ�������������ѡab��


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ϳɰ���Ӧ��N2��g��+3H2��g��2NH3��g����H=��92.4kJmol��1 �� �ڷ�Ӧ�����У�����Ӧ���ʵı仯��ͼ������˵����ȷ���ǣ� �� 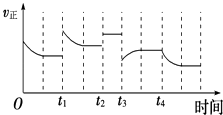
A.t1ʱ�������¶�
B.t2ʱʹ���˴���
C.t3ʱ������ѹǿ
D.t4ʱ�������¶�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Ҫ�������
��1�������Ƿ�չ�е�����Դ���������ð�������Ʊ��������Ӧ���������ڡ��ش��������⣺
����������ȣ�������Ϊȼ�ϵ��ŵ���_____________________(���ٴ������)��
������̫����ֱ�ӷֽ�ˮ���⣬�����������������;����������ת����ʽΪ____________��
��2���л���M����̫������տ�ת����N��ת���������£�
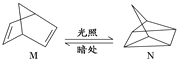 ��H����88.6 kJ��mol��1����M��N��ȣ����ȶ�����____________��
��H����88.6 kJ��mol��1����M��N��ȣ����ȶ�����____________��
��3������͵�������ı������������ʡ���ʯī�����ۺͶ�������һ��������ϸ��������գ�����������²��ϣ�4Al(s)��3TiO2(s)��3C(s)===2Al2O3(s)��3TiC(s)��H����1 176 kJ��mol��1����Ӧ�����У�ÿת��1 mol���ӷų�������Ϊ______________��
��4����һ���¶��£�4 L�ܱ�������ijһ��Ӧ������M������N�����ʵ�����ʱ��仯��������ͼ��
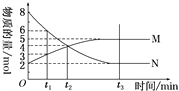
�ٸ÷�Ӧ�Ļ�ѧ����ʽΪ____________________________��
����t2��2 min�����㷴Ӧ��ʼ��t2ʱ����M��Ũ�ȱ仯��ʾ��ƽ����Ӧ����Ϊ______________��
��t2ʱ�̣���Ӧ���ת����Ϊ______________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ϳɰ�������ع�ҵ�У��������ʼ��ת����ϵ���£�

����˵������ȷ���ǣ�������
A. ��Ӧ��������������ԭ��Ӧ
B. ����ת���а����˰��������ᡢ��李�С�մ���Ĺ�ҵ��������
C. ��Ӧ���͢��еIJ��ֲ����������������ѭ������
D. ��ӦV�������Ȼ�����Һ��ͨCO2��������ͨNH3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ѡ��Ļ������У��ڳ��¡���ѹ����Һ̬��ʽ���ڵ��ǣ� ��
A.����
B.��Ȳ
C.��ϩ
D.�Ҵ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1��ҩ�ﰲȫ�ǹ��Ҹ߶����ӵ��������⣬��ѧ������ҩ����о��й��������⣬������ѡ�����ĸ������ա�
A����˾ƥ�֣�����ˮ���ᣩ B����ù�� C������ҩ������������ D����Ƽ�
�� ����θ����࣬���������ص�θ����Ӧ��ѡ��_______��
�� ������֧���������������˹�����ã������˷ܣ���ҩ�����_______��
�� ��һ����Ҫ�Ŀ�������ҩ������ֹ����ϸ�������Ĺ��ܣ���ҩ����_______��
�� ��ʹ���ȵIJ������½�����������������ʹ�����ã���ҩ����_______��
��2��2017��11��23�գ�������������ʽ�ͻ�C919�ܻ��ں��չ�ҵ�Է��������ת��������������״��Էɣ���־��C919��ȡ���ʺ�֤������Ͷ�뺽����Ӫ�����ؼ�һ����
�ٻ�����Ƥʹ�õ��ǵ�������﮺Ͻ���ϡ����в�������﮺Ͻ����ʵ���_______ (����ĸ)��

a���ܶȴ� ��b��Ӳ�ȴ� c������ʴ
�ڷɻ���̥��������Ʒ�����в��Ͽ������ϳ�����_______ (����ĸ)��
a��ʯӢɰ ��b�������ϩ c��ʯ��ʯ
�ۻ����Ƚ����ϲ��ϵ�ʹ���ʴ�12%���������ڸ��ϲ��ϵ���_______ (����ĸ)��
a���ѺϽ� �� b����ͨ�մ� c��������
��3�����õ���̬�����Ϳ�ѧ����ʳ�������������������������⣬������ѡ�����ĸ������ա�
�ٳ�������ƻ����������߶Ե�������������ӣ��Ӷ�ʹȫ��Ƥ�����ķ������������ӡ������һ�������Ҫԭ����_______��
A������ʹ�÷�����
B������ʱ�ŷ��˴�����¯ú��
C��ʯ�����Ƴ��ŷ��˴����ļ��顢����
D�����ᡢ���Ṥ���ŷ��˴����Ķ��������һ������
�� ����˵����ȷ����_______��
A��Ϊʹ���ȳ���ɫ���ʺ죬Ӧ���һЩ��������
B��Ϊ��ȡ�㹻�ĵ����ʣ�Ӧ����⡢�ٳԶ���Ʒ
C��Ϊ�������ڼ�ȩ��Ⱦ��Ӧ�ᳫ���Ҽ�װ��
D��Ϊ��ǿӤ����ʳ����Ӧ��Ӥ��ʳƷ�ж����ɫ��
�� ˮ����Ⱦ�Ӿ���ˮ��Դ�Ķ�ȱ��������Hg2+���ؽ������ӵķ�ˮ���õķ�����_________��
A�������� B���кͷ� C������ D��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������й�������;��˵���У�����ȷ����
A. ������������� B. �����������컯��
C. ����������������ʢװŨ���� D. ����������������ɫ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ݵ���������Ӧ���Ȼ�ѧ����ʽ
��1��I2(g)+H2(g)![]() 2HI(g) ��H=-9.48 kJ��mol-1
2HI(g) ��H=-9.48 kJ��mol-1
��2��I2(s)+H2(g)![]() 2HI(g) ��H="+26.48" kJ��mol-1
2HI(g) ��H="+26.48" kJ��mol-1
�����ж���ȷ����( )
A. 254 g I2(g)��ͨ��2 g H2(g),��Ӧ����9.48 kJ
B. 1 mol��̬����1 mol��̬���������������17.00 kJ
C. ��Ӧ��1���IJ���ȷ�Ӧ��2���IJ����ȶ�
D. ��Ӧ��2���ķ�Ӧ����������ȷ�Ӧ��1���ķ�Ӧ�����������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����̵�ص����С�������������dz��õ�һ�ε�ء��õ�ط�Ӧԭ����ͼ��ʾ�����е����LiClO4���ڻ���л��ܼ��У�Li+ ͨ�������Ǩ����MnO2�����У�����LiMnO2��
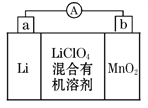
�ش��������⣺
��1�����·�ĵ�����������__________������__________����������ĸ��
��2�����������ӦʽΪ________________________________________��
��3���Ƿ����ˮ�������еĻ���л��ܼ���_______����ǡ�����ԭ����____________________________________________________________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com