
����Ŀ��һ���¶��£������������Ϊ1.0 L�ĺ����ܱ������з�����Ӧ��2CH3OH(g�� ![]() CH3OCH3(g����H2O(g��������˵����ȷ����
CH3OCH3(g����H2O(g��������˵����ȷ����
������� | �¶�(���� | ��ʼ���ʵ���(mol�� | ƽ�����ʵ��� | |
CH3OH(g�� | CH3OCH3(g�� | H2O(g�� | ||
�� | 387 | 0.20 | 0.080 | 0.080 |
�� | 387 | 0.40 | ||
�� | 207 | 0.20 | 0.090 | 0.090 |
A���÷�Ӧ������ӦΪ���ȷ�Ӧ
B���ﵽƽ��ʱ���������е�CH3OH����������������е�С
C���������з�Ӧ����ƽ������ʱ����������еij�
D������ʼʱ���������г���CH3OH 0.1mol��CH3OCH3 0.15mol��H2O 0.10mol����Ӧ��������Ӧ�������
���𰸡�D
��������
���������A����������ƽ��ʱc(CH3OCH3��=c(H2O��=![]() =0.080mol/L��c(CH3OH��=
=0.080mol/L��c(CH3OH��=![]() =0.04mol/L���������л�ѧƽ�ⳣ��K1=
=0.04mol/L���������л�ѧƽ�ⳣ��K1=![]() =4����������ƽ��ʱc(CH3OCH3��=c(H2O��=
=4����������ƽ��ʱc(CH3OCH3��=c(H2O��=![]() =0.090mol/L��c(CH3OH��=
=0.090mol/L��c(CH3OH��=![]() =0.02mol/L����ѧƽ�ⳣ��K2=
=0.02mol/L����ѧƽ�ⳣ��K2=![]() =20.25��4�����Խ����¶ȣ���ѧƽ�ⳣ������Ӧ������Ӧ�����ƶ���������Ӧ�Ƿ��ȷ�Ӧ����A��ȷ��B�����������£��������൱�����������Ļ����ϼ�ѹ�������ڸ÷�Ӧ�Ƿ�Ӧǰ�������������ķ�Ӧ�����ƽ�ⲻ�ƶ��������������е�CH3OH����������������е���ȣ���B����C���������е��¶ȱ�����III���¶ȸߣ��¶�Խ�߷�Ӧ����Խ�죬�ﵽƽ������ʱ��Խ�̣���C����D��c(CH3OH��=0.1mol/L��c(CH3OCH3 ��=0.15mol/L��c(H2O��=0.10mol/L��Ũ����=
=20.25��4�����Խ����¶ȣ���ѧƽ�ⳣ������Ӧ������Ӧ�����ƶ���������Ӧ�Ƿ��ȷ�Ӧ����A��ȷ��B�����������£��������൱�����������Ļ����ϼ�ѹ�������ڸ÷�Ӧ�Ƿ�Ӧǰ�������������ķ�Ӧ�����ƽ�ⲻ�ƶ��������������е�CH3OH����������������е���ȣ���B����C���������е��¶ȱ�����III���¶ȸߣ��¶�Խ�߷�Ӧ����Խ�죬�ﵽƽ������ʱ��Խ�̣���C����D��c(CH3OH��=0.1mol/L��c(CH3OCH3 ��=0.15mol/L��c(H2O��=0.10mol/L��Ũ����=![]() =1.5��4��ƽ��������Ӧ�����ƶ�����D��ȷ����ѡD��
=1.5��4��ƽ��������Ӧ�����ƶ�����D��ȷ����ѡD��


 ��ͼͼ�麮����ҵ������ҵ���ִ�ѧ������ϵ�д�
��ͼͼ�麮����ҵ������ҵ���ִ�ѧ������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������й�ԭ�ӽṹ��˵������ȷ���� �� ��
A. ϡ������Ԫ��ԭ�ӵ���������������8 B. �ǽ���Ԫ�ص�����������������3
C. ����Ԫ�ص�������������С��4 D. ��ԭ�ӵĵ����������ζԳƵ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������I2O5������CO��Ⱦ�����ⶨCO����ӦΪ��5CO(g����I2O5(s��![]() 5CO2(g����I2(s��,��ͬ�¶��£���װ������I2O5�����2 L�����ܱ�������ͨ��2molCO�����CO2�����������(CO2����ʱ��t�仯������ͼ������˵������ȷ����
5CO2(g����I2(s��,��ͬ�¶��£���װ������I2O5�����2 L�����ܱ�������ͨ��2molCO�����CO2�����������(CO2����ʱ��t�仯������ͼ������˵������ȷ����
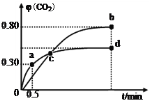
A�������������ܶȲ��䣬������Ӧ�ﵽƽ��״̬
B�������¶��£�c��ʱ��ϵ�л�������ƽ����Է����������
C��0~0.5����Ӧ����Ϊv(CO��=1.2mol��L-1��min-1
D��b���d��Ļ�ѧƽ�ⳣ����Kb��Kd
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ֲ���纣���������к��зḻ�ĵ�Ԫ�أ���Ҫ�Ե⻯����ʽ���ڣ���һ��ѧ����С���ú���Ϊԭ����ȡ�����ⵥ�ʣ����ǽ��������ճɻң���ˮ����һ��ʱ��(���õ⻯�����ܽ���ˮ�������õ�����������Һ��Ȼ������ʵ��������ȡ���ʵ⣺
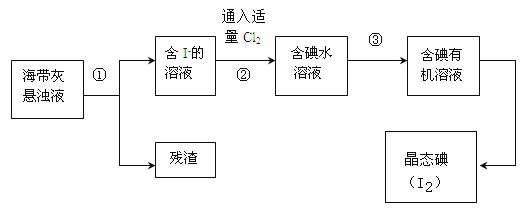
��1�����պ���ʱ��Ҫ�õ���ʵ�������� (������������ѡ��������������ñ����ĸ��д�ڿհ״�����
A�ձ� B��� C������ D����̨(����Ȧ�� E�ƾ��� F������
��2��ָ����ȡ��Ĺ������йص�ʵ��������ƣ��� ���� ��
��3���������г�������Cl2��Ŀ���� ����Ӧ�����ӷ���ʽΪ ��
��4�������������õ��л��Լ������� (ֻ��һ����������ѡ�������� ��
��5���������������Էֽ�Ϊ���¼�����
A����ʢ����Һ�ķ�Һ©����������̨����Ȧ�У�
B����50mL��ˮ��15mL�л��ܼ�(����ѡ���������Һ©���У����Ǻò�������
C�������Һ©���������ϿڵIJ������Ƿ�©Һ��
D����ת©������������ʱ�����������������رջ������ѷ�Һ©��������
E���������������ձ�������Һ��
F���ӷ�Һ©���Ͽڵ����ϲ�Һ�壻
G����©���ϿڵIJ�������ʹ���ϵİ�����©���Ͽڵ�С����
H�����á��ֲ㣮
a������G��������Ŀ���ǣ� ��
b��������л���Һ��ͨ�� ���(�©���Ͽڡ���©���¿ڡ�����
��6�������һ�ּ�����ȡ����ˮ��Һ���Ƿ��е��ʵ�ļ��� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������һ�ֻ�ѧ���ʻ��õ����塣��1�����Ʊ�����ˮ��dz����ɫ��˵����ˮ���� ���Ӵ�����д��ѧʽ��������ˮ�е��뼸��AgNO3��Һ�������� ��
��2����ͼ��ʾ������������ͨ��ʢ�и�����ɫ�����Ĺ��ƿ��ʢ�г�ʪ��ɫ�����Ĺ��ƿ���ɹ۲�������� ��
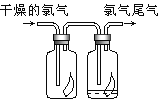
��3��Ϊ��ֹ������Ⱦ���������� ��Һ���ն�����������÷�Ӧ�Ļ�ѧ����ʽΪ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ƿ��һ�ֶ�����������ƿ���ϱ��У����¶ȡ���Ũ�ȡ�����������ѹǿ���ݿ̶��ߡ����ܶ�
�������еģ� ��
A.�ڢܢ�
B.�ۢݢ�
C.�٢ڢ�
D.�٢ۢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʵ��������������ǣ� ��
A. ��ʪ���pH��ֽ��ϡ��Һ��pH���ⶨֵƫС
B. ������ƿ������Һ������ʱ���ӿ̶��ߣ�������ҺŨ��ƫС
C. �ζ�ǰ�ζ����������ݣ��յ����ʱ�����ݣ��������ƫС
D. �ⶨ�кͷ�Ӧ����Ӧ��ʱ��������������У������¶�ֵƫС
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��̼���仯��������Դ�����ϵȷ�����й㷺����;���ش��������⣺
��1��̼��Ͳ����Ϊ��Ԫ���ᣬ������Ϊ�������У���֪����볣�����й��������±�����Na2CO3��Һ�еμӲ�����Һ����ʼʱ��������Ӧ�����ӷ���ʽΪ ��
H2CO3 | H2C2O4 | |
K1 | 4.2��10-7 | 5.4��10-2 |
K2 | 5.6��10-11 | 5.4��10-5 |
��2������ʱ��C��CO��ȼ������H�ֱ�Ϊ��394.0 kJ��mol-1����283.0 kJ��mol-1����������Cת��ΪCO���Ȼ�ѧ����ʽΪ ��
��3��������һ����̼��һ�������¿ɺϳɼ״�����Ӧ����
2H2(g����CO(g��![]() CH3OH(g�� ��H��Q kJ��mol-1��
CH3OH(g�� ��H��Q kJ��mol-1��
���÷�Ӧ�ڲ�ͬ�¶��µĻ�ѧƽ�ⳣ��(K�����±���
�¶�(���� | 250 | 300 | 350 |
K(L2��mol-1�� | 2.041 | 0.270 | 0.012 |
�ɴ˿��ж�Q 0(�������������������
��һ���¶��£���6 mol H2��2mol CO���뵽���Ϊ2 L���ܱ������У�10 minʱ��Ӧ�ﵽƽ��״̬����ʱ���c(CO����0.2 mol��L-1�����¶��µ�ƽ�ⳣ��K�� ��0��10 min�ڣ���Ӧ����v(CH3OH���� ��
���������ܱ������зֱ���20 mol H2��10 mol CO�����һ����̼��ƽ��ת�������¶�(T����ѹǿ(p���ı仯����ͼ��ʾ��
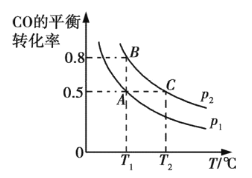
A��B����ѹǿ��С��ϵ��p1 p2(�����������������������A���Ӧ�������ݻ�Ϊ20 L����B���Ӧ���������ݻ�Ϊ L��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ȼú�����е�CO2ת��Ϊ�����ѵķ�Ӧԭ��Ϊ��2CO2(g)+6H2(g)![]() CH3OCH3(g)+3H2O(g)��һ�������£��������������Ϊ1.0L�����ܱ��������ң��ڼ��г���0.1molCO2��0.2molH2�������г���0.2molCO2��0.4molH2������������Ӧ���ﵽƽ�⡣�÷�Ӧ��CO2��ƽ��ת�������¶��ı仯������ͼ��ʾ������˵����ȷ����
CH3OCH3(g)+3H2O(g)��һ�������£��������������Ϊ1.0L�����ܱ��������ң��ڼ��г���0.1molCO2��0.2molH2�������г���0.2molCO2��0.4molH2������������Ӧ���ﵽƽ�⡣�÷�Ӧ��CO2��ƽ��ת�������¶��ı仯������ͼ��ʾ������˵����ȷ����

A����Ӧ2CO2(g)+6H2(g)![]() CH3OCH3(g) + 3H2O(g)�� ��S<0����H<0
CH3OCH3(g) + 3H2O(g)�� ��S<0����H<0
B����ʾ������CO2��ƽ��ת�������¶��仯��������B
C����ϵ��c(CH3OCH3)��c(CH3OCH3,״̬��)<2c(CH3OCH3,״̬��)
D���淴Ӧ����v����v��(״̬��)<v��(״̬��)
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com