
分析 向含有物质的量均为1mol 的KOH、Ba(OH)2、NH3•H2O、NaAlO2混合溶液中通入CO2气体,生成白色沉淀为碳酸钡沉淀→沉淀增加→沉淀不变为二氧化碳和氨水反应生成碳酸氢铵→沉淀再增加为生成氢氧化铝沉淀→沉淀不变→沉淀部分减少为碳酸钡转化为碳酸氢钡→沉淀不变,据此分析解答.
解答 解:含有物质的量均为1mol 的KOH、Ba(OH)2、NH3•H2O、NaAlO2混合溶液中通入CO2气体,生成白色沉淀,反应为:Ba2++2OH-+CO2=BaCO3↓+H2O,→沉淀增加→沉淀不变为NH3+H2O+CO2CO2=NH4++HCO3-→沉淀再增加,反应为:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-;→沉淀不变,反应为:CO32-+CO2+H2O=2HCO3-,→沉淀部分减少,反应为:BaCO3+H2O+CO2=Ba2++2HCO3-→沉淀不变为Al(OH)3.
故答案为:Ba2++2OH-+CO2=BaCO3↓+H2O;CO32-+CO2+H2O=2HCO3-.
点评 本题考查了物质性质的分析应用,主要是试剂量不同产物本题的产物判断,反应现象的分析应用,掌握物质性质是解题关键,题目难度中等.


 小学教材全测系列答案
小学教材全测系列答案 小学数学口算题卡脱口而出系列答案
小学数学口算题卡脱口而出系列答案 优秀生应用题卡口算天天练系列答案
优秀生应用题卡口算天天练系列答案 浙江之星课时优化作业系列答案
浙江之星课时优化作业系列答案科目:高中化学 来源: 题型:选择题
| A. | 相同温度下,将足量氯化银固体分别放入相同体积的①蒸馏水 ②0.1 mol/L盐酸③0.1 mol/L氯化镁溶液 ④0.1 mol/L硝酸银溶液中,Ag+浓度:①>④=②>③ | |
| B. | 在含有BaSO4沉淀的溶液中加入Na2SO4固体,c(Ba2+)增大 | |
| C. | 向Mg(OH)2悬浊液中滴加FeCl3溶液,沉淀变为红褐色,说明溶解度Mg(OH)2>Fe(OH)3 | |
| D. | 已知I3-?I2+I-,向盛有KI3溶液的试管中加入适量CCl4,振荡静置后CCl4层显紫色,说明KI3在CCl4中的溶解度比在水中的大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
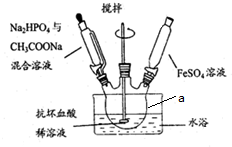
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | b>c | B. | a+b>2c | C. | a+b<c | D. | a+b<2c |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 | |
| 第2周期 | ① | ② | ③ | |||||
| 第3周期 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 第4周期 | ⑨ | ⑩ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 利用H++OH-═H2O來测量某氢氧化钠溶液的浓度时:甲基橙--橙色 | |
| B. | 利用“2Fe3++2I-═I2+2Fe2+,用NaI溶液测量Fe(NO3)3样品中Fe(NO3)3百分含量:淀粉--蓝色 | |
| C. | 利用“Ag++SCN-=AgSCN↓原理,可用标准KSCN溶液含量AgNO3溶液浓度:Fe(NO3)3--血 红色 | |
| D. | 用标准酸性KMnO4溶液滴定NaHSO3溶液以测量其浓度:KMnO4--紫红色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| W | X | Y |
| Z |
| A. | 四种元素的原子半径:r(Z)>r(X)>r(Y)>r(W) | |
| B. | 四种元素形成的单质最多有6种 | |
| C. | X与Y形成的气态化合物超过两种 | |
| D. | 四种元素中,Z的最高价氧化物对应的水化物酸性最强 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com