(1)盖斯定律认为:不管化学过程是一步完成或分数步完成,整个过程的总
热效应相同.试运用盖斯定律回答下列问题:
已知:C
2H
5OH(g)+3O
2(g)=2CO
2(g)+3H
2O(g);△H
1=-Q
1 kJ/mol,
C
2H
5OH(g)=C
2H
5OH(l);△H
2=-Q
2 kJ/mol,H
2O(g)=H
2O(l);△H
3=-Q
3 kJ/mol.若使23g液态无水酒精完全燃烧,并恢复到室温,则整个过程中放出的热量为
0.5Q1-0.5Q2+1.5Q3
0.5Q1-0.5Q2+1.5Q3
kJ.
(2)北京奥运会祥云火炬将中国传统文化、奥运精神以及现代高科技融为一体.火炬内熊熊大火来源于丙烷的燃烧,丙烷是一种优良的燃料.试回答下列问题:
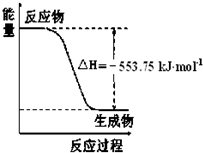
①如图是一定量丙烷完全燃烧生成CO
2和1mol H
2O(l)过程中的能量变化图,请写出表示丙烷燃烧热的热化学方程式
C3H8(g)+5O2(g)=3CO2(g)+4H2O(l);△H1=-2215.0 kJ/mol
C3H8(g)+5O2(g)=3CO2(g)+4H2O(l);△H1=-2215.0 kJ/mol
.
②近年来已经研制出丙烷燃料电池,该电池的电解质溶液为KOH溶液,写出该电池负极的电极反应式:
C3H8-20e-+26 OH-=3CO32-+17H2O
C3H8-20e-+26 OH-=3CO32-+17H2O
.
③某金属的相对原子质量为52.00,用上述电池电解该金属的一种含氧酸盐的酸性水溶液时,阳极每放出 3360ml(标准状况)氧气体,阴极析出金属 10.4g,在该含氧酸盐中金属的化合价为
+3
+3
,在该实验中,若不考虑能量的损失,电池中消耗丙烷的质量最少是
1.32
1.32
g(结果精确至0.01g).?
④二甲醚(CH
3OCH
3)是一种新型燃料,应用前景广阔.1mol二甲醚完全燃烧生成CO
2和液态水放出1455kJ热量.若1mol丙烷和二甲醚的混合气体完全燃烧生成CO
2和液态水共放出1645kJ热量,则混合气体中,丙烷和二甲醚的物质的量之比为
1:3
1:3
.



 (1)盖斯定律认为:不管化学过程是一步完成或分数步完成,整个过程的总
(1)盖斯定律认为:不管化学过程是一步完成或分数步完成,整个过程的总