
【题目】Ⅰ 硫化氢(H2S)的转化是资源利用和环境保护的重要研究课题。
(1)H2S和CO混合加热可制得羰基硫(COS),羰基疏可作粮食熏蒸剂,能防止其些昆虫、线虫和真菌的危害。反应方程式为CO(g)+H2S(g)=COS(g)+H2(g)。
①羰基硫的电子式为__________。
②下列能说明碳与硫两元素非金属性相对强弱的是_______(填字母代号)。
a.相同条件下水溶液的pH:Na2CO3>Na2SO4
b.酸性:H2SO3>H2CO3
c.S与H2的化合比C与H2的化合更容易
(2)H2S具有还原性,在酸性条件下,能与KMnO4反应生成S、MnSO4、K2SO4和H2O,写出该反应的化学方程式____________。
(3)H2S气体溶于水形成的氢硫酸是一种二元弱酸,25℃时,在0.10mol·L-1 H2S溶液中,通入HCl气体或加入NaOH固体以调节溶液pH,溶液pH与c(S2-)关系如图所示(忽略溶液体积的变化、H2S的挥发)。
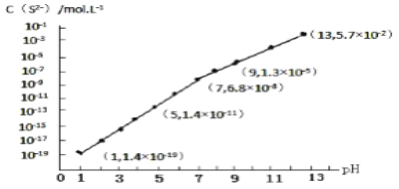
①pH=13时,溶液中的c(H2S)+c(HS-)=______ mol·L-1。
②某溶液含0.020 mol·L-1Mn2+、0.10 mol·L-1H2S,当溶液pH=_______时,Mn2+开始沉淀。[已知:Ksp(MnS)=2.8×10-13]。
Ⅱ.降低 SO2的排放量已经写入 2018 年政府工作报告, 化石燃料燃烧时会产生含 SO2的废气进入大气,污染环境,有多种方法可用于 SO2的脱除。
①NaClO 碱性溶液吸收法。工业上可用 NaClO 碱性溶液吸收 SO2。
i.反应离子方程式是__________。
为了提高吸收效率,常用 Ni2O3作为催化剂。在反应过程中产生的四价镍和原子氧具有极强的氧化能力,可加快对 SO2的吸收。该催化过程的示意图如下图所示:
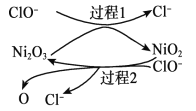
ii.过程 1 的离子方程式是__________。
iii.Ca(ClO)2也可用于脱硫,且脱硫效果比 NaClO 更好,原因是__________。
②电化学脱硫法。某种电化学脱硫法装置如下图所示,不仅可脱除烟气中的SO2还可以制得 H2SO4。
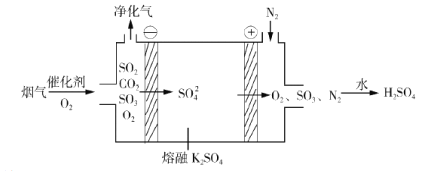
i.在阴极放电的物质是______。
ii.在阳极生成 SO3的电极反应式是______。
【答案】![]() ac 5H2S+2KMnO4+3H2SO4=5S↓+2MnSO4+K2SO4+8H2O 0.043 5 ClO-+SO2+2OH- ===Cl-+SO42-+H2O Ni2O3+ClO- ===2NiO2 +Cl- Ca2+与SO42-结合生成微溶的CaSO4有利于反应的进行 O2 SO2 - 2e- +SO42-= 2SO3
ac 5H2S+2KMnO4+3H2SO4=5S↓+2MnSO4+K2SO4+8H2O 0.043 5 ClO-+SO2+2OH- ===Cl-+SO42-+H2O Ni2O3+ClO- ===2NiO2 +Cl- Ca2+与SO42-结合生成微溶的CaSO4有利于反应的进行 O2 SO2 - 2e- +SO42-= 2SO3
【解析】
Ⅰ(1)①羰基硫分子中所有原子均满足8电子结构,可看作是二氧化碳分子中的一个氧原子被硫原子代替,由此和CO2对比书写羰基硫分子的电子式;
②相同条件下,钠盐的PH对应酸的酸性越弱;最高价氧化物水化物的酸性也强,非金属性越强,不是最高价则无法比较;非金属单质和氢气化合越容易、氢化物越稳定,非金属性越强。
(2)根据题给信息,书写化学方程式;
(3)①依据物料守恒分析;②依据![]() 计算Mn2+开始沉淀时的
计算Mn2+开始沉淀时的![]() 。
。
Ⅱ. ①NaClO 碱性溶液吸收法,工业上可用 NaClO 碱性溶液吸收 SO2。
i.利用NaClO的氧化性,将SO2在溶液中氧化成H2SO4;
ii. 由图可以看出过程 1 的反应是,ClO-和Ni2O3反应生成Cl-和NiO2;
iii Ca(ClO)2也可用于脱硫,且脱硫效果比 NaClO 更好,是因为 Ca2+与SO42-结合生成微溶的CaSO4有利于反应的进行。
②由电化学脱硫装置可知,该装置为电解池,依据电极反应分析解答相关问题。
Ⅰ(1)①由羰基硫分子中所有原子均满足8电子结构,可看作是二氧化碳分子中的一个氧原子被硫原子代替,则羰基硫分子的电子式应为![]() 。
。
本题答案为:![]() 。
。
②a项,相同条件下水溶液的![]() :
:![]() ,说明碳酸的酸性弱于硫酸,碳酸和硫酸为C和S的最高价氧化物对应的水化物,则证明非金属性S
,说明碳酸的酸性弱于硫酸,碳酸和硫酸为C和S的最高价氧化物对应的水化物,则证明非金属性S![]() C,故选a项;
C,故选a项;
b项,由于HSO3不是S的最高价氧化物对应的水化物,无法比较二者的非金属性大小,故不选b项;
c项,S与H2的化合比C与H2的化合更容易,说明S形成的氢化物比C的氢化物更稳定,即![]() 非金属性更强,故选c项;
非金属性更强,故选c项;
本题答案为ac。
(2)H2S与KMnO4在酸性条件下反应的化学方程式为:![]() 。
。
本题答案为:5H2S![]() 2KMnO4
2KMnO4![]() 3H2SO4=3S
3H2SO4=3S![]() 2MnSO4
2MnSO4![]() K2SO4
K2SO4![]() 8H2O。
8H2O。
(3)①溶液中存在![]() ,当
,当![]() 时,
时,![]() ,则
,则![]() ;
;
本题答案为:0.043nol/L。
②根据![]() 可知,
可知,![]() 开始沉淀时,
开始沉淀时,![]() ,此时对应溶液的
,此时对应溶液的![]() 值为5。
值为5。
本题答案为:5.
Ⅱ①NaClO 碱性溶液吸收法,工业上可用 NaClO 碱性溶液吸收 SO2。
i.利用NaClO的氧化性,将SO2在溶液中氧化成H2SO4,离子方程式为:ClO-+SO2+2OH- ===Cl-+SO42-+H2O;
本题答案为:ClO-+SO2+2OH- ===Cl-+SO42-+H2O。
ii.由图可以看出过程 1 的反应是,ClO-和Ni2O3反应生成Cl-和NiO2,离子方程式为:Ni2O3+ClO- ===2NiO2 +Cl-;
本题答案为:Ni2O3+ClO- ===2NiO2 +Cl-。
iii Ca(ClO)2也可用于脱硫,且脱硫效果比NaClO 更好,是因为 Ca2+与SO42-结合生成微溶的CaSO4有利于反应的进行;
本题答案为:Ca2+与SO42-结合生成微溶的CaSO4有利于反应的进行。
②由电化学脱硫装置可知,该装置为电解池,烟气经催化氧化后,部分二氧化硫,被氧化成三氧化硫,所得气体通过该装置,在阴极O2得到电子被还原,电极反应式为:O2![]() 4e-
4e-![]() 2SO3=2SO42-;在阳极,SO2失去电子,被氧化成SO3,电极反应式为:SO2-2e-
2SO3=2SO42-;在阳极,SO2失去电子,被氧化成SO3,电极反应式为:SO2-2e-![]() SO42-=2SO3;
SO42-=2SO3;
则i.在阴极放电的物质是:O2。
ii.在阳极生成 SO3的电极反应式是:SO2-2e-![]() SO42-=2SO3。
SO42-=2SO3。
本题答案为:O2,SO2-2e-![]() SO42-=2SO3。
SO42-=2SO3。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】缓冲和供氧是维持人体正常生理活动的两个重要平衡系统,回答下列问题:
Ⅰ.人体血液中存在平衡:H2CO3 (aq)![]() H+(aq)+HCO3-(aq) △H,该平衡可使血液的pH维持在一定范围内。
H+(aq)+HCO3-(aq) △H,该平衡可使血液的pH维持在一定范围内。
(1)已知:
CO2(g)![]() CO2(aq) △H1=akJ·mol-l;
CO2(aq) △H1=akJ·mol-l;
CO2(aq)+H2O(l)![]() H2CO3 (aq) △H2=bkJ mol-1;
H2CO3 (aq) △H2=bkJ mol-1;
HCO3-(aq)![]() H+(aq)+CO32-(aq) △H3=ckJ mol-1;
H+(aq)+CO32-(aq) △H3=ckJ mol-1;
CO2(g)+H2O(l)![]() 2H+(aq)+CO32-(aq) △H4=dkJ mol-1。
2H+(aq)+CO32-(aq) △H4=dkJ mol-1。
则上述电离方程式中△H =_____________(用含a、b、c、d的代数式表示)。
(2)若某人血液中c(HCO3-):c(H2CO3)=20:1,pKa1(H2CO3)=6.1,则该人血液的pH=_____________,pH升高,则![]() ___(填“增大”“减小”或“不变”)。
___(填“增大”“减小”或“不变”)。
(3)当有少量酸性物质进入血液后,血液的pH变化不大,用平衡移动原理解释上述现象:_____________。
Ⅱ.肌细胞石储存氧气和分配氧气时存在如下平衡:
Mb(aq)+O2(g)![]() MbO2(aq)。
MbO2(aq)。
肌红蛋白 氧合肌红蛋白
(4)经测定动物体温升高,氧气的结合度[α(MbO2),氧合肌红蛋白的浓度占肌红蛋白初始浓度的百分数]降低,则该反应的△H_______________(填“>”或“<”)0。
(5)温度为37 ℃时,氧气的结合度[α(MbO2)与氧气的平衡分压[p(O2)]关系如下图所示:
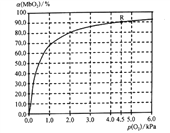
①利用R点所示数据,计算37 ℃时该反应的平衡常数K=_________________(氧气的平衡浓度可用氧气的平衡分压代替求算)。
②已知37 ℃时,该反应的正反应速率v(正)=k1c(Mb)×p(O2),逆反应速率v(逆)=k2c(MbO2),若k2=60s-1,则k1=___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属(M)–空气电池(如图)具有原料易得、能量密度高等优点,有望成为新能源汽车和移动设备的电源。该类电池放电的总反应方程式为:4M+nO2+2nH2O=4M(OH) n。已知:电池的“理论比能量”指单位质量的电极材料理论上能释放出的最大电能。下列说法不正确的是

A. 采用多孔电极的目的是提高电极与电解质溶液的接触面积,并有利于氧气扩散至电极表面
B. 比较Mg、Al、Zn三种金属–空气电池,Al–空气电池的理论比能量最高
C. M–空气电池放电过程的正极反应式:4Mn++nO2+2nH2O+4ne–=4M(OH)n
D. 在Mg–空气电池中,为防止负极区沉积Mg(OH)2,宜采用中性电解质及阳离子交换膜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】前20号元素W、X、Y、Z的原子序数依次增大,且分列四个不同周期和四个不同主族。其中A为Y元素组成的单质;甲、乙、丙、丁、戊为上述四种元素组成的二元或三元化合物;常温下乙为液体。下列说法正确的是
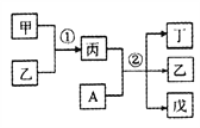
A. 简单离子半径:Z>Y
B. 反应①为吸热反应
C. 反应②属于氧化还原反应,A即是氧化剂又是还原剂
D. X、Y分别与Z形成的化合物中,化学键类型一定相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中只含有Na+、Al3+、Cl、SO42四种离子,已知前三种离子的个数比为5∶2∶1,则溶液中Al3+和SO42的离子个数比为
A. 1∶2 B. 1∶4 C. 3∶4 D. 2∶5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生产、生活密切相关,下列说法正确的是( )
A.石油的分馏和煤的液化都是物理变化
B.聚乙烯塑料的老化是因为发生了加成反应
C.被称为“黑金”的新型纳米材料石墨烯属于有机化合物
D.利用化学工艺调整织物孔隙直径,可以制作出防水透气面料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向100 mL FeI2溶液中逐渐通入Cl2,其中n(I2)、n(Fe3+)随通入n(Cl2)的变化如图所示,下列说法不正确的是
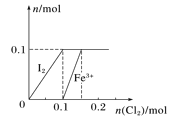
A. 还原性强弱:Fe2+<I-
B. n(Cl2)=0.12 mol时,溶液中的离子主要有Fe2+、Fe3+、Cl-
C. 由图可知,该FeI2溶液的浓度为1mol·L-l
D. n(Cl2)∶n(FeI2)=1∶2时,反应的离子方程式为:2Fe2++Cl2===2Fe3++2Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有八种短周期主族元素x、y、z、d、e、f、 g、h,其中x、y、d、f随着原子序数的递增,其原子半径的相对大小、最高正价或最低负价的变化如图1所示。z、e、g、h的最高价氧化物对应水化物溶液(浓度均为0.01 mol/L)的pH与原子序数的关系如图2所示。
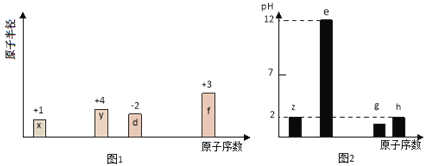
根据上述信息进行判断,并回答下列问题:
(1)g在元素周期表中的位置是____________________。
(2)比较d、e、f的简单离子半径大小为______<______<______(用离子符号表示);y、h 的最高价氧化物对应水化物酸性较强的是__________(用化学式表示)。
(3)下列可作为比较e和f金属性强弱的依据是________。
A.测等浓度相应氯化物水溶液的pH
B.测两种元素单质的硬度和熔、沸点
C.比较单质做还原剂时失去的电子数目的多少
D.比较两种元素在化合物中化合价的高低
E.比较单质与同浓度盐酸反应的剧烈程度
(4)据报道,最近意大利科学家获得了极具研究价值的z4,其分子结构与白磷分子(P4)的正四面体结构相似。已知断裂1 mol z-z键吸收167 kJ热量,生成1 mol Z≡Z键放出942 kJ热量,请写出z4气体在一定条件下生成z2气体反应的热化学方程式___________________。
(5)由上述元素中的y、z、e组成的某剧毒化合物eyz不慎泄露时,消防人员通常采用喷洒过氧化氢溶液的方式处理,以减少污染。反应生成一种酸式盐和一种气体,二者溶于水均呈碱性,该反应的化学方程式为___________________________________________。已知eyz含有z2分子中类似的化学键,写出化合物eyz的电子式____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com