
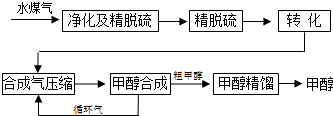
| 物质 | H2 | CO | CH3OH |
| 浓度/mol?L-1 | 0.2 | 0.1 | 0.4 |
| △c |
| △t |
| c(CO)c(H2) |
| c(H2O) |
| c(CO)c(H2) |
| c(H2O) |
| 0.4 |
| 0.2 2×0.1 |
| 0.3mol/L |
| 10min |


科目:高中化学 来源: 题型:
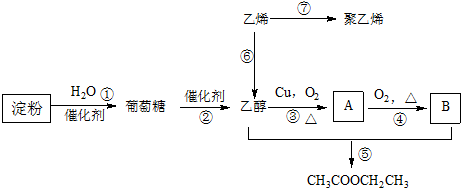
| ||
| △ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、醋酸溶液中离子浓度的关系满足:c(H+)=c(OH-)+c(CH3COO-) |
| B、0.10mol/L的CH3COOH溶液中加水稀释,溶液中c(OH-)增大 |
| C、CH3COOH溶液中加少量的CH3COONa固体,平衡逆向移动 |
| D、pH=2的CH3COOH溶液与pH=12的NaOH溶液等体积混合后,溶液的pH>7 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、乙醇、丙醇 |
| B、乙醇、乙二醇 |
| C、1-丙醇、丙二醇 |
| D、乙烯、丙烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ② | |||
| ⑦ | ⑧ |
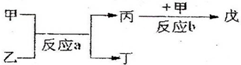
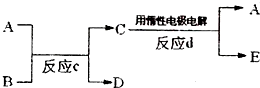
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、④③①②⑤ |
| B、④⑤③②① |
| C、④③②①⑤ |
| D、④②③①⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:
 中和滴定:
中和滴定:| 锥形 瓶中 溶液 | 滴定 管中 溶液 | 选用 指示剂 | 选用 滴定管 | |
| A | 碱 | 酸 | 石蕊 | (甲) |
| B | 酸 | 碱 | 酚酞 | (甲) |
| C | 碱 | 酸 | 甲基橙 | (甲) |
| D | 酸 | 碱 | 酚酞 | (乙) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2CO(g)+O2(g)═2CO2(g);△H=-556kJ?mol-1 | ||
| B、CH4(g)+2O2(g)═CO2(g)+2H2O(l);△H=-890kJ?mol-1 | ||
C、H2(g)+
| ||
| D、H2(g)+Cl2(g)═2HCl(g);△H=-184.6kJ?mol-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com