
【题目】下列化学反应中,既是离子反应,又是氧化还原反应的是
A.2NaOH+H2SO4=Na2SO4+2H2O
B.Fe+H2SO4=FeSO4+H2↑
C.BaCl2+H2SO4=BaSO4↓+2HCl
D.H2+CuO=Cu+H2O
科目:高中化学 来源: 题型:
【题目】硫的化合物在生产生活中有广泛应用。
(1)硫化钠主要用于皮革、毛纺、高档纸张、染料等行业。生产硫化钠大多采用无水芒硝(Na2SO4)-炭粉还原法,其流程示意图如下:

① 上述流程中采用稀碱液比用热水更好,理由是__________________。
② 取硫化钠晶体(含少量NaOH)加入到硫酸铜溶液中,充分搅拌。若反应后测得溶液的pH=4,则此时溶液中c( S2-)=______mol·L-1。(已知:常温时CuS、Cu(OH)2的Ksp分别为8.8×10-36、2.2×10-20)
(2)工业上常利用废碱渣(主要成分Na2CO3)吸收硫酸厂尾气中的SO2制备无水Na2SO3。KIO3滴定法可测定成品中Na2SO3的含量:室温下将0.1260g 成品溶于水并加入淀粉做指示剂,再用0.01000 mol·L1 KIO3酸性标准溶液滴定至终点,消耗KIO3溶液31.25mL。
① 滴定终点观察到的现象为:_____________________。
② 成品中Na2SO3的质量分数是_________(请写出计算过程)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】湿法炼锌产生的铜镉渣主要含锌、铜、铁、镉(Cd)、钴(Co)等单质。一种由铜镉渣生产金属镉的流程如下:

下表列出了相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为0.1mol/L计算):
氢氧化物 | Fe(OH)3 | Fe(OH)2 | Cd(OH)2 |
开始沉淀的pH | 1.5 | 6.5 | 7.2 |
沉淀完全的pH | 3.3 | 9.9 | 9.5 |
(1)浸出过程中,不采用通入空气的方法进行搅拌,原因是防止将Cu氧化浸出,其离子方程式是__________________。
(2)除钴过程中,锌粉会与As2O3形成微电池产生AsH3。该微电池的正极反应式为_____。
(3)除铁时先加入适量KMnO4,再加入ZnO调节pH。
① 除铁过程中,理论上参加反应的物质n(KMnO4)∶n(Fe2+)=_________。
② 除铁时加入ZnO控制反应液pH的范围为________________。
(4)若上述流程中投入的KMnO4不足量,则待电解溶液中有Fe元素残余。请设计实验方案加以验证:_____________________。
(5)净化后的溶液用惰性电极电解可获得镉单质。电解废液中可循环利用的溶质是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【2016届会宁县一中第四次月考】铁及其化合物在日常生活、生产中应用广泛。
(1)高铁酸钠(Na2FeO4)是水处理过程中的一种新型净水剂,工业上利用NaClO 和NaOH的混合溶液将2Fe(OH)3氧化性制备高铁酸钠,反应的化学方程式为 ;高铁酸钠能用作新型净水剂的原理是 ;
(2)氧化铁红颜料跟某些油料混合,可以制成防锈油漆。以黄铁矿为原料制硫酸产生的硫酸渣中含Fe2O3、SiO2、Al2O3、MgO等,用硫酸渣制备铁红(Fe2O3)的过程如下:
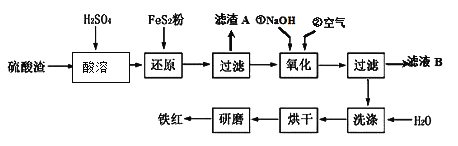
①酸溶过程中发生反应的化学方程式为 , , ;“滤渣A”主要成份的化学式为 。
②还原过程中加入FeS2的目的是将溶液中的Fe3 +还原为Fe2 +,而本身被氧化为H2SO4,请写出该反应的离子方程式 ;
③氧化过程中,O2、NaOH与Fe2+反应的离子方程式为 。
④为了确保铁红的质量和纯度,氧化过程需要调节溶液的pH的范围是 ,
沉淀物 | Fe(OH)3 | Al(OH)3 | Fe(OH)2 | Mg(OH)2 |
开始沉淀pH | 2.7 | 3.8 | 7.6 | 9.4 |
完全沉淀pH | 3.2 | 5.2 | 9.7 | 12.4 |
如果pH过大,可能引起的后果是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某铝合金中含有元素铝、铁、铜、硅。为了测定该合金中铝的含量,设计了如下实验,请回答有关问题:
(1)称取样品ag(精确到0.1g),称量时通常使用的主要仪器的名称是_______。
(2)将样品溶解于足量的稀盐酸,过滤并洗涤滤渣。溶解、过滤用到的玻璃仪器有_______。(3)向滤液中加过量的氢氧化钠溶液,过滤并洗涤滤渣。
(4)向步骤(3)的滤液中通入足量的二氧化碳气体,过滤并洗涤滤渣,生成沉淀的离子方程式是___________。
(5)将步骤(4)的滤渣烘干并灼烧至恒重、冷却后称重,其质量为bg。有关反应的化学方程式是_______________,原样品中铝的质量分数是_______。(用含a、b的代数式表示)
(6)若步骤(5)的滤渣灼烧不充分,则实验结果______(填“偏高”、“偏低”或“不影响”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【2015北京理综化学】在通风橱中进行下列实验:
步骤 |
|
| |
现象 | Fe表面产生大量无色气泡,液面上方变为红棕色 | Fe表面产生少量红棕色气泡后,迅速停止 | Fe、Cu接触后,其表面产生红棕色气泡 |
下列说法中不正确的是 ( )
A.Ⅰ中气体有无色变红棕色的化学方程式为:2NO+O2=2NO2
B.Ⅱ中的现象说明Fe表面形成致密的氧化层,阻止Fe进一步反应
C.对比Ⅰ、Ⅱ中现象,说明稀HNO3的氧化性强于浓HNO3
D.针对Ⅲ中现象,在Fe、Cu之间连接电流计,可判断Fe是否被氧化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“绿色化学”是当今社会提出的一个新概念。在“绿色化学”工艺中,理想状态是反应中原子全部转化为目标产物,即原子利用率为100%。利用以下各种化学反应类型的合成过程最符合绿色化学的是
A.取代反应 B.水解反应 C.加聚反应 D.缩聚反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实,不能用勒夏特列原理解释的是( )
A.在合成氨的工业生产中要及时将生成的氨分离出去
B.对 2HI(g) H2(g)+I2(g)平衡体系,增大压强可使颜色变深
C.溴水中有下列平衡 Br2+H2OHBr+HBrO,当加入 AgNO3 溶液后,溶液颜色变浅
D.合成氨反应,为提高氨的产率,理论上不宜采用高温
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】烃A是一种重要的化工原料,A完全燃烧后生成m(CO2):m(H2O)=22:9,A在同系物中相对分子质量最小。现有如下图转化关系:

请回答:
(1)有机物A中含有的官能团名称为_________。
(2)有机物F与氢氧化钠溶液反应的化学方程式为_____________。
(3)有机物E能使溴的四氯化碳溶液褪色,其原因是_________(用化学方程式表示)。
(4)下列说法不正确的是_________
A.B![]() C可通过如下两步直接实现:①热铜丝催化氧化,②直接与新制Cu(OH)2共热
C可通过如下两步直接实现:①热铜丝催化氧化,②直接与新制Cu(OH)2共热
B.将绿豆大小的钠投入到B中,钠块浮在液面上,并产生气泡
C.若C![]() E为加成反应,则D为乙炔
E为加成反应,则D为乙炔
D.为制备干燥的F,可在分离出F后,选用碱石灰做干燥剂
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com