
【题目】某铝合金中含有元素铝、铁、铜、硅。为了测定该合金中铝的含量,设计了如下实验,请回答有关问题:
(1)称取样品ag(精确到0.1g),称量时通常使用的主要仪器的名称是_______。
(2)将样品溶解于足量的稀盐酸,过滤并洗涤滤渣。溶解、过滤用到的玻璃仪器有_______。(3)向滤液中加过量的氢氧化钠溶液,过滤并洗涤滤渣。
(4)向步骤(3)的滤液中通入足量的二氧化碳气体,过滤并洗涤滤渣,生成沉淀的离子方程式是___________。
(5)将步骤(4)的滤渣烘干并灼烧至恒重、冷却后称重,其质量为bg。有关反应的化学方程式是_______________,原样品中铝的质量分数是_______。(用含a、b的代数式表示)
(6)若步骤(5)的滤渣灼烧不充分,则实验结果______(填“偏高”、“偏低”或“不影响”)
【答案】 托盘天平 烧杯、玻璃棒、漏斗 AlO2-+CO2+2H2O=Al(OH)3↓+HCO3- 2Al(OH)3![]() Al2O3+3H2O
Al2O3+3H2O ![]() 偏高
偏高
【解析】本题考查物质含量的测定,(1)称量固体因为精确到0.1g,因此使用托盘天平称量;(2)溶解时用到的仪器是烧杯、玻璃棒,过滤时用到的玻璃仪器是烧杯、漏斗、玻璃棒;(4)步骤(2)中的反应是2Al+6H+=2Al3++3H2↑、Fe+2H+=Fe2++H2↑,铜和硅不与盐酸反应,步骤(3)向滤液中加入足量的氢氧化钠溶液,发生Fe2++2OH-=Fe(OH)2↓,Al3++4OH-=AlO2-+2H2O,向滤液中通入足量的CO2,发生的离子反应方程式为AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-;(5)氢氧化铝受热分解,反应方程式为2Al(OH)3 ![]() Al2O3+3H2O,氧化铝的质量为bg,根据铝元素守恒,样品中Al的质量分数为2×27b/102a×100%=
Al2O3+3H2O,氧化铝的质量为bg,根据铝元素守恒,样品中Al的质量分数为2×27b/102a×100%=![]() ;(6)灼烧不充分,灼烧后固体质量增大,b的质量增大,即所测铝的质量分数偏高。
;(6)灼烧不充分,灼烧后固体质量增大,b的质量增大,即所测铝的质量分数偏高。


科目:高中化学 来源: 题型:
【题目】用下列装置进行相应实验,能达到实验目的的是
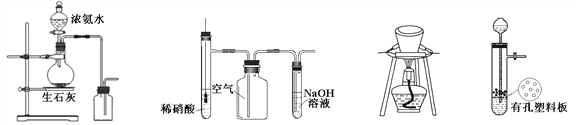
图1 图2 图3 图4
A. 图1所示装置制取并收集氨气
B. 图2所示装置用于制备并收集NO气体
C. 图3所示装置用于除去碳酸氢钠固体中的少量碳酸钠
D. 图4所示装置用于Na2CO3和稀H2SO4反应制取少量的CO2气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(上海市虹口区2017届高三)下列有关HCl和HBr的叙述错误的是
A. 键能:HBr>HCl B. 键长:HBr>HCl
C. 沸点:HBr>HCl D. 共用电子对偏向:HCl>HBr
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学反应中,既是离子反应,又是氧化还原反应的是
A.2NaOH+H2SO4=Na2SO4+2H2O
B.Fe+H2SO4=FeSO4+H2↑
C.BaCl2+H2SO4=BaSO4↓+2HCl
D.H2+CuO=Cu+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【2015福建理综化学】纯净物X、Y、Z转化关系如右图所示,下列判断正确的是 ( )

A.X可能是金属铜
B.Y不可能是氢气
C.Z可能是氯化钠
D.Z可能是三氧化硫
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下硝酸铵受热分解的化学方程式为:5NH4NO3=2HNO3+4N2+9H2O,在反应中被氧化与被还原的氮原子数之比为
A. 5∶4
B. 5∶3
C. 3∶5
D. 1∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组反应(表内物质均为反应物)刚开始时,放出H2的速率最大的是( )
编号 | 金属(粉末状) | 物质的量 | 酸的浓度 | 酸的体积 | 反应温度 |
A | Mg | 0.1mol | 6mol/L硝酸 | 10mL | 60℃ |
B | Mg | 0.1mol | 3mol/L盐酸 | 10mL | 30℃ |
C | Fe | 0.1mol | 3mol/L盐酸 | 10mL | 60℃ |
D | Mg | 0.1mol | 3mol/L盐酸 | 10mL | 60℃ |
A.A
B.B
C.C
D.D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com