
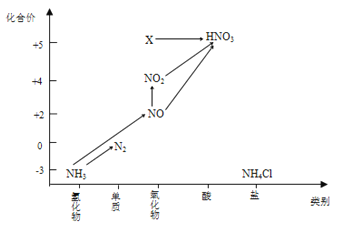
����Ŀ������ͼ�е�Ԫ�ؼ��仯�����ת����ϵ���ش����⣺
��1��ʵ���ҳ���NH4Cl��Ca(OH)2��ȡ�������÷�Ӧ�Ļ�ѧ����ʽΪ__________________��
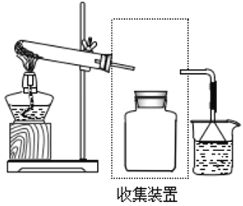
��2����Ҫ�ռ�һƿ����������ͼ����ڻ�������ͼ_____��
��3����ҵ����NH3��������ˮΪԭ����������Ĺ������̼�ͼ������ʾ��
![]()
д��NH3��NO�Ļ�ѧ����ʽ__________________________________��
��4��ͼ�У�X�Ļ�ѧʽΪ_______����Xת��ΪHNO3����______________��Ӧ���������ԭ����������ԭ������Ӧ��
��5����Ҫ��NH3��N2����ԭ���Ͽ��������Լ����е���________������ţ���
A��O2 B��Na C��NH4Cl D��NO2
���𰸡�2NH4Cl��Ca(OH)2![]() 2NH3����CaCl2��2H2O
2NH3����CaCl2��2H2O  4NH3��5O2
4NH3��5O2![]() 4NO��6H2O N2O5 ��������ԭ AD
4NO��6H2O N2O5 ��������ԭ AD
��������
��1��ʵ���ҳ���NH4Cl��Ca(OH)2��ȡ�����������Ȼ��ơ�������ˮ��
��2��������������ˮ���ȿ����ᣬ�ռ�����ֻ���������ſ������ռ���������λ�ö̽�������
��3�������Ĵ�������4NH3+5O2![]() 4NO+6H2O����NO��NO2ʵ����������ɫ����仯Ϊ����ɫ���壻�۶���������ˮ��Ӧ����һ�����������
4NO+6H2O����NO��NO2ʵ����������ɫ����仯Ϊ����ɫ���壻�۶���������ˮ��Ӧ����һ�����������
��4��ͼ1������֪X���ϼ���������ͬΪ+5�ۣ���������Ϊ�����X��ѧʽΪ��N2O5�������������Ͽ���X��������������N2O5+2H2O=2HNO3��ת��ΪHNO3���ڷ�������ԭ��Ӧ��
��7����Ҫ��NH3��N2,��ԭ���Ͽ������������Ե��Լ����У�
��1��ʵ���ҳ���NH4Cl��Ca(OH)2��ȡ�����������Ȼ��ơ�������ˮ����ѧ����ʽΪ2NH4Cl+Ca(OH)2![]() CaCl2+2NH3+2H2O��
CaCl2+2NH3+2H2O��
��ȷ�𰸣�2NH4Cl��Ca(OH)2![]() 2NH3����CaCl2��2H2O
2NH3����CaCl2��2H2O
��2��������������ˮ���ȿ����ᣬ�ռ�����ֻ���������ſ������ռ���������λ�ö̽������� ��
��
��ȷ�𰸣�
��3�������Ĵ�������4NH3+5O2![]() 4NO+6H2O����NO��NO2ʵ����������ɫ����仯Ϊ����ɫ���壻�۶���������ˮ��Ӧ����һ�����������ᣬ��Ӧ�Ļ�ѧ����ʽΪ��3NO2+H2O=2HNO3+NO��
4NO+6H2O����NO��NO2ʵ����������ɫ����仯Ϊ����ɫ���壻�۶���������ˮ��Ӧ����һ�����������ᣬ��Ӧ�Ļ�ѧ����ʽΪ��3NO2+H2O=2HNO3+NO��
��ȷ�𰸣�4NH3+5O2![]() 4NO+6H2O��
4NO+6H2O��
��4��ͼ1������֪X���ϼ���������ͬΪ+5�ۣ���������Ϊ�����X��ѧʽΪ��N2O5�������������Ͽ���X��������������N2O5+2H2O=2HNO3��ת��ΪHNO3���ڷ�������ԭ��Ӧ��
��ȷ�𰸣�N2O5 ��������ԭ��
��7����Ҫ��NH3��N2,��ԭ���Ͽ������������Ե��Լ����У�
A.O2���������ԣ���A��ȷ��
B.Naֻ���л�ԭ�ԣ���B����
C.NH4Cl�백������Ӧ����C����
D.NO2���������ԣ���D��ȷ��
��ȷ�𰸣�AD


 ͬ����ϰǿ����չϵ�д�
ͬ����ϰǿ����չϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1��K2Cr2O7 + 14HCl= 2KCl + 2CrCl3 + 3Cl2��+ 7H2O ���á������š���ʾ����ת�Ƶķ������Ŀ��___,���������뻹ԭ��������ʵ���֮��Ϊ_____________��
��2��______mol H2O�й�����9.03��1022��ԭ�ӣ�������Ϊ_______��
��3����ƽ����������ԭ��Ӧ����ʽ��___KMnO4+___H2S+__H2SO4(ϡ) ��__MnSO4+__S��+__K2SO4+__H2O
��4��Cl2��һ���ж����壬���й©��������صĻ�����Ⱦ������������Ũ��ˮ������Cl2�Ƿ�й©���йط�Ӧ�Ļ�ѧ����ʽΪ��3Cl2��������8NH3��������6NH4Cl���̣���N2������������Ӧ������Cl2 1.5 mol, ��������NH3�ڱ�״���µ����Ϊ______ L��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����г�����ѡ�õ��Լ���������������ȷ��һ����(������Ϊ����)
ѡ�� | ���ᴿ������ | ѡ�õ��Լ� | �������� |
A | NaHCO3(Na2CO3) | �������� | �����ᾧ |
B | CO2(CO) | O2 | ��ȼ |
C | Mg(Al) | ����������Һ | ���� |
D | CO2(HCl) | ����������Һ | ϴ�� |
A. A B. B C. C D. D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��Һ��Na+��Cu2+��Ba2+��Fe3+��AlO![]() ��CO
��CO![]() ��SO
��SO![]() ��Cl�е�������������ɣ�ȡ��������Һ��������ʵ�飺����˵����ȷ����
��Cl�е�������������ɣ�ȡ��������Һ��������ʵ�飺����˵����ȷ����

A. ԭ��Һ��һ��ֻ����![]() ��
��![]() ��
��![]() ��Cl-��������
��Cl-��������
B. ����A�Ļ�ѧʽ��CO2�������ʽΪO::C::O
C. ԭ��Һ��һ�������ڵ�������Cu2+��Ba2+��Fe3+
D. ���ɳ���B�����ӷ���ʽΪ��Al3++3OH===Al(OH)3��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��NA��ʾ�����ӵ���������ֵ��������������ȷ����
A. ���³�ѹ�£�1.7 g�����к��е�ԭ����ĿΪ0.4NA
B. 50 mL 1 mol��L1 K2SO4��Һ�к��е�K+��ĿΪ0.1NA
C. 5.6 g��������ϡ���ᷴӦת�Ƶĵ�����Ϊ0.3NA
D. ��״���£�4.48 L�������͵����Ļ���ﺬ�еķ�����ĿΪ0.2NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ�����ڻ�ѧ��ռ����Ҫ��λ����ش��������⣺
��1��0.3 mol NH3����������ԭ������Լ__________��H2O����������ԭ������ȡ�
��2��V mL��a g Al3+��Al2(SO4)3��Һ������SO42�����ʵ���Ũ��Ϊ_____ mol��L1��
��3����һ���¶Ⱥ�ѹǿ�£�1�������X2��3���Y2��������2�����̬������û�����Ļ�ѧʽΪ_________��
��4������0.3 mol���ơ�þ�����ֱ����100 mL 1 mol��L1�������У�ͬ��ͬѹ�²�������������Ϊ_____________��
��5��п���ϡ�����ᷴӦ��������п������狀�ˮ��������1 mol����пʱ���μӷ�Ӧ����������ʵ���Ϊ_________ mol��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������ָ������������½���ѧ��ת��Ϊ���ܵ�װ�ã��乤��ԭ����ͼ��ʾ�������й������ص�˵��������� ( )

A. ������Ӧ����CO2����
B. ����ٽ��˷�Ӧ�е��ӵ�ת��
C. ����ͨ������Ĥ�Ӹ���������������
D. ����ܷ�ӦΪC6H12O6��6O2===6CO2��6H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����0.2molMn02��50mL12mol/L�����Ϻ���ȣ���Ӧ��ȫ�������µ���Һ�м�������AgNO3��Һ������AgCl�������ʵ���Ϊ������������Ļӷ����� ��
A. ����0.3mol B. ��0.3mol C. ���� 0.3mol���� 0.6mol D. ���� 0.6mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ҹ��Ŵ��ļ���Ӧ���У��乤��ԭ�����漰��ѧ��Ӧ����
A.ɳ���Խ�B.��ʳ���C.��ҩʹ��D.����ұ��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com