
【题目】化学计量在化学中占有重要地位。请回答下列问题:
(1)0.3 mol NH3分子中所含原子数与约__________个H2O分子中所含原子数相等。
(2)V mL含a g Al3+的Al2(SO4)3溶液中所含SO42的物质的量浓度为_____ mol·L1。
(3)在一定温度和压强下,1体积气体X2与3体积Y2化合生成2体积气态化合物,该化合物的化学式为_________。
(4)将各0.3 mol的钠、镁、铝分别放入100 mL 1 mol·L1的盐酸中,同温同压下产生气体的体积比为_____________。
(5)锌与很稀的硝酸反应生成硝酸锌、硝酸铵和水,当生成1 mol硝酸锌时,参加反应的硝酸的物质的量为_________ mol。
【答案】2.408×1023 500a∕9V XY3或Y3X 3:1:1 2.5
【解析】
(1)先求出氨气分子中原子的物质的量,在根据NH3与H2O中原子个数相同求出水分子的物质的量,在乘以阿伏伽德罗常数即得结果;
(2)先求出铝离子的物质的量,再根据与硫酸根离子的个数比2:3求出硫酸根离子的物质的量,在除以溶液体积即得SO42的物质的量浓度;
(3)根据质量守恒定律计算;
(4)将三种金属各0.3mol分别投入100mL 1mol/L的盐酸中,可知三种金属都过量,应按盐酸的量计算,镁、铝产生氢气物质的量相等,产生氢气的物质的量为:(0.1L×1mol/L)×1/2=0.05 mol,但金属钠活泼,能与水反应生成氢气,则生成氢气最多的是钠,钠与水反应产生氢气应按钠的物质的量计算:0.3mol钠产生0.15mol氢气;
(5)硝酸具有氧化性,可以将金属氧化到最高价,被还原的硝酸生成硝酸铵,据此结合方程式来计算回答。
(1)0.3mol NH3分子中含有的原子的物质的量为0.3mol×4=1.2mol,则n(H2O)=![]() =0.4mol,二者含有的原子个数相等,N(H2O)=0.4mol×6.02×1023/mol=2.408×1023;
=0.4mol,二者含有的原子个数相等,N(H2O)=0.4mol×6.02×1023/mol=2.408×1023;
正确答案:2.408×1023
(2)SO42的物质的量浓度为![]() mol·L1。
mol·L1。
正确答案: 500a∕9V;
(3)设生成的气体的化学式为A,同温同压下,气体的体积之比等于物质的量之比,1体积X2(气)和3体积Y2(气)化合生成2体积气态化合物,则反应方程式为X2+3Y2=2A,根据原子守恒,所以A为XY3或Y3X;
正确答案:XY3或Y3X;
(4)将三种金属各0.3mol分别投入100mL 1mol/L的盐酸中,可知三种金属都过量,应按盐酸的量计算,镁、铝产生氢气物质的量相等,产生氢气的物质的量为:(0.1L×1mol/L)×1/2=0.05 mol,但金属钠活泼,能与水反应生成氢气,则生成氢气最多的是钠,钠与水反应产生氢气应按钠的物质的量计算:0.3mol钠产生0.15mol氢气。故将钠、镁、铝各0.3mol 分别放入100mL 1mol/L的盐酸中,产生氢气的物质的量之比为:0.15mol:0.05mol:0.05mol=3:1:1,所以同温同压下产生的气体体积比是3:1:1;
正确答案:3:1:1。
(5)反应的方程式可以表达为:4Zn+10HNO3(稀)=4Zn(NO3)2+NH4NO3+5H2O,生成1mol的硝酸锌,参加反应的硝酸10/4=2.5mol
正确答案:2.5。


科目:高中化学 来源: 题型:
【题目】关于反应Fe+CuSO4=Cu+FeSO4下列关于该反应的说法正确的是( )
A.Fe是氧化剂B.CuSO4被氧化
C.Fe失去电子D.CuSO4发生氧化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是某学校购买的硫酸试剂标签上的部分内容.据此下列说法正确的是( )

A. 该硫酸的物质的量浓度为1.84mol/L
B. 1mol Zn与足量的该硫酸反应产生2gH2
C. 配制200mL 4.6mol/L的稀硫酸需取该硫酸50mL
D. 该硫酸与等体积的水混合所得溶液的物质的量浓度等于9.2mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F都是链状有机物,它们的转化关系如图所示。A是一种氯代烃,只含有一种官能团,D中含有两种官能团,D分子中不含甲基,且与碳原子相连的氢原子取代所得的一氯代物只有1种。请回答下列问题:

(1)D的分子式 ___________________。
(2)写出D的结构简式____________________,A的结构简式_________________。
(3)写出B生成C的化学方程式 _________________________________。
(4)写出C与新制氢氧化铜悬浊液反应的化学方程式_____________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】依据图中氮元素及其化合物的转化关系,回答问题:
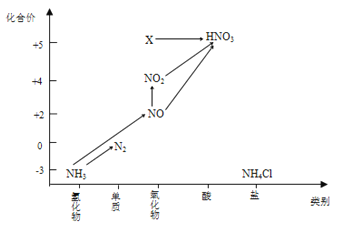
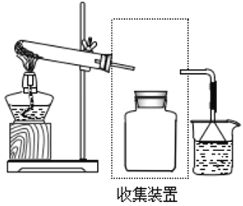
(1)实验室常用NH4Cl与Ca(OH)2制取氨气,该反应的化学方程式为__________________。
(2)若要收集一瓶氨气,请在图虚框内画出连接图_____。
(3)工业上以NH3、空气、水为原料生产硝酸的工艺流程简图如下所示:
![]()
写出NH3→NO的化学方程式__________________________________。
(4)图中,X的化学式为_______,将X转化为HNO3属于______________反应(填“氧化还原”或“非氧化还原”)反应。
(5)若要将NH3→N2,从原理上看,下列试剂可行的是________(填序号)。
A.O2 B.Na C.NH4Cl D.NO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有人设想以N2和H2为反应物,以溶有X的稀盐酸为电解质溶液,制造出新型燃料电池,装置如图所示。下列说法正确的是
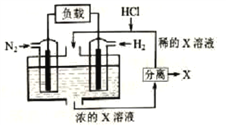
A. 放电时H+向左移动,生成的物质X是NH4Cl
B. 通入H2的一极为正极
C. 通入N2的电极反应为:N2+6H+-6e-=2NH3
D. 放电过程右边区域溶液pH逐渐增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用CO和H2在催化剂的作用下合成甲醇,发生如下反应:CO(g)+2H2(g)![]() CH3OH(g)。在体积一定的密闭容器中按物质的量之比1∶2充入CO和H2,测得平衡混合物中CH3OH的体积分数在不同压强下随温度的变化情况如图1所示。现有两个体积相同的恒容密闭容器甲和乙,向甲中加入1mol CO和2 molH2,向乙中加入2 molCO和4molH2, 测得不同温度下CO的平衡转化率如图2所示。下列说法正确的是
CH3OH(g)。在体积一定的密闭容器中按物质的量之比1∶2充入CO和H2,测得平衡混合物中CH3OH的体积分数在不同压强下随温度的变化情况如图1所示。现有两个体积相同的恒容密闭容器甲和乙,向甲中加入1mol CO和2 molH2,向乙中加入2 molCO和4molH2, 测得不同温度下CO的平衡转化率如图2所示。下列说法正确的是

A. 该反应的ΔH> 0; P1> P2 B. 反应速率B点高于D点
C. A、C两点的平衡常数相同 D. M、L两点中,CH3OH的体积分数相同,且p(M)= 2p(L)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向NaOH和Na2CO3混合溶液中滴加0.1molL-1稀盐酸,CO2的生成量与加入盐酸的体积(V)的关系如图 所示。下列判断正确的是
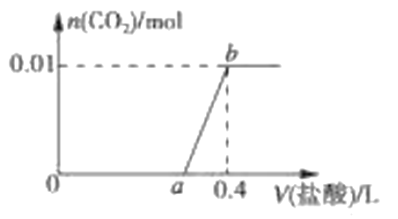
A. 在0a范围内,只发生NaOH和HCl的反应
B. ab段发生反应的离子方程式为:CO32-+2H+=CO2↑+H2O
C. a=0.3
D. 原混合溶液中NaOH与Na2CO3的物质的量之比为1:2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com