
| A. | 一定条件下,将1 mol N2和3 mol H2混合发生反应,转移的电子总数为6 NA | |
| B. | 1 L 0.1 mol•L-1的Na2CO3溶液中阴离子的总数大于0.1 NA | |
| C. | 标准状况下,44.8LHF中含有分子的数目为2NA | |
| D. | 1 mol-CH3中所含的电子总数为10 NA |
分析 A.氮气与氢气合成氨气为可逆反应,可逆反应不能进行到底;
B.碳酸根离子水解生成氢氧根离子和碳酸氢根离子;
C.标况下HF为液体;
D.依据取代基的结构计算电子数.
解答 解;A.氮气与氢气合成氨气为可逆反应,将1 mol N2和3 mol H2混合发生反应生成氨气小于2mol,转移的电子总数小于6 NA,故A错误;
B.碳酸根离子水解生成氢氧根离子和碳酸氢根离子,所以1 L 0.1 mol•L-1的Na2CO3溶液中阴离子的总数大于0.1 NA,故B正确;
C.标准状况下,HF为液体,不能使用气体摩尔体积,故C错误;
D.1mol甲基(-CH3)所含的电子总数=(6+3)×NA=9NA,故D错误;
故选:B.
点评 本题考查了阿伏伽德罗常数的应用,主要考查烷烃的结构,取代基的结构,气体摩尔体积的条件应用,盐类水解规律,注意标况下HF不是气体,题目难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | b、c与a形成化合物的稳定性一定为c>b | |
| B. | a和d形成的化合物与水反应产生气体可以作燃料 | |
| C. | c、a和b可形成的化合物为离子化合物 | |
| D. | a、b、c、d四种元素组成的化合物的水溶液可以为酸性、也可以为碱性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
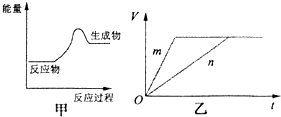 现有反应:A.CaCO3═CaO+CO2
现有反应:A.CaCO3═CaO+CO2 查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | AlCl3 | B. | FeCl3 | C. | FeCl2 | D. | MgCl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验 | 实验药品 | 实验器材(省略加持装置) | |
| A | 制备氧气 | 双氧水、二氧化锰 | 分液漏斗、烧瓶、酒精灯、导管 |
| B | 除去CO2中的HCl气体 | 饱和Na2CO3溶液 | 洗气瓶、导管 |
| C | 配制0.5mol/L、230mL的稀硫酸溶液 | 用98%、1.84g/mL的浓硫酸6.8ml | 10mL量筒、烧杯、玻璃棒、胶头滴管、250容量瓶 |
| D | 检验碳与浓硫酸加热产生的气体中是否含有CO2 | 澄清石灰水 | 烧杯、导管 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
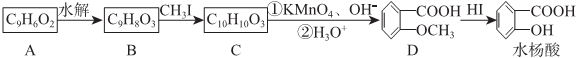
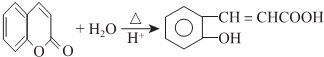
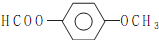
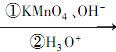 RCOOH+R1COOH
RCOOH+R1COOH .
. .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HOCH2CH2CH2OH | B. | CH3OH | C. | CH3CH2OH | D. | HOCH2CH2OH |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com