
【题目】二氧化碳是导致温室效应的主要气体,其对应的水溶液碳酸是可乐饮料的主要成分之一。回答下列问题:
(1)下列事实中,能证明碳酸是弱酸的是________.
A.碳酸不稳定,易分解为二氧化碳和水
B.用氢氧化钠溶液中和等浓度的碳酸溶液,需要氢氧化钠溶液的体积是碳酸体积的2倍
C.相同条件下,碳酸的导电能力低于相同浓度的硫酸溶液
D.常温下,5.0×10-6mol/L的碳酸溶液pH值为6
(2)煤的燃烧也是导致温室效应的原因之一,其燃烧有下列两种途径:
途径I:C(s)+O2(g)=CO2(g) ΔH=Q1kJ/mol
途径II:先制水煤气:C(s)+H2O(g)=CO(g)+H2(g) ΔH=Q2kJ/mol;再燃烧水煤气:CO(g)+1/2O2(g)=CO2(g) ΔH=Q3kJ/mol;H2(g)+1/2O2(g)=H2O(g) ΔH=Q4kJ/mol则Q1、Q2、Q3、Q4的数学关系式是___________________________________;
(3)常温常压下,空气中的CO2溶于水,达到平衡时,溶液的pH=5.6,c(H2CO3)=1.5×10-5 mol/L。
①向饱和碳酸溶液中分别加入下列物质,能使碳酸的第一步电离平衡向右移动的是_________
A.HCl气体 B.NaOH固体 C.Na单质 D.苯酚钠溶液
②若忽略水的电离及H2CO3的第二级电离,则H2CO3![]() HCO3-+H+的平衡常数K1=_______。(已知:10-5.6=2.5×10-6,保留一位小数);
HCO3-+H+的平衡常数K1=_______。(已知:10-5.6=2.5×10-6,保留一位小数);
【答案】CD Q1=Q2+Q3+Q4 BCD 4.2×10-7 mol·L-1
【解析】
(1) A.碳酸易分解为二氧化碳和水, 说明碳酸不稳定;故A错误;B.用氢氧化钠溶液中和等浓度的碳酸溶液,需要氢氧化钠溶液的体积是碳酸体积的2倍,说明碳酸是二元酸,不能证明是弱酸,故B错误;C.导电能力取决于溶液中自由离子浓度的大小,相同条件下,碳酸的导电能力低于相同浓度的硫酸溶液,说明碳酸没有完全电离,即存在电离平衡,说明碳酸是弱酸,故C正确;D.常温下,5.0![]() 10-6mo/L的碳酸溶液,若完全电离,则c(H+)=1.0
10-6mo/L的碳酸溶液,若完全电离,则c(H+)=1.0![]() 10-5mol/L,即pH值为5,但实际上溶液pH值为6,说明碳酸没有完全电离,因此碳酸是弱酸。答案为CD。
10-5mol/L,即pH值为5,但实际上溶液pH值为6,说明碳酸没有完全电离,因此碳酸是弱酸。答案为CD。
(2)由 ①C(s)+H2O(g)=CO(g)+H2(g)ΔH=Q2kJ/mol;②CO(g)+1/2O2(g)=CO2(g)ΔH=Q3kJ/mol;③H2(g)+1/2O2(g)=H2O(g)ΔH=Q4kJ/mol知 ①+②+③得: C(s)+O2(g)=CO2(g)所以Q1、Q2、Q3、Q4的关系式是Q1=Q2+Q3+Q4;答案:Q1=Q2+Q3+Q4。
(3) ①H2CO3=HCO3-+H+ HCO3-=H+ + CO32-,A.向饱和碳酸溶液加入HCl气体平衡向左移动: B.向饱和碳酸溶液加入NaOH固体平衡向右移动;C.向饱和碳酸溶液加入Na单质平衡向右移动: 因为苯酚的酸性比碳酸弱,所以向饱和碳酸溶液加入苯酚钠溶液平衡向右移动。答案:BCD。
②pH=5.6,c(H+)=, c(H2CO3)=1.5×10-5 mol/L。若忽略水的电离及H2CO3的第二级电离,则H2CO3![]() HCO3-+H+的平衡常数K1=c(H+)
HCO3-+H+的平衡常数K1=c(H+)![]() c(HCO3-)/c(H2CO3)=( 1
c(HCO3-)/c(H2CO3)=( 1![]() 10-5.6)2/ 1.5×10-5 =4.2×10-7 mol·L-1。
10-5.6)2/ 1.5×10-5 =4.2×10-7 mol·L-1。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】区别下列各组物质,所选择的试剂或方法错误的是( )
A.铁丝和铜丝--观察颜色
B.白酒和白醋--闻气味
C.空气、氮气和氧气--带火星的木条
D.空气和呼出气体--澄清石灰水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由于温室效应和资源短缺等问题,如何降低大气中的CO2含量并加以开发利用,引用了各界的普遍重视。目前工业上有一种方法是用CO2生产燃料甲醇。一定条件下发生反应:CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g),该反应的能量变化如图所示:
CH3OH(g)+H2O(g),该反应的能量变化如图所示:
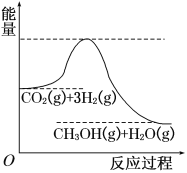
(1)上述反应平衡常数K的表达式为________________,温度降低,平衡常数K________(填“增大”、“不变”或“减小”)。
(2)在体积为2 L的密闭容器中,充入1 mol CO2和3 mol H2,测得CO2的物质的量随时间变化如下表所示。从反应开始到5 min末,用氢气浓度变化表示的平均反应速率v(H2)=________。从反应到平衡时CO2转化率=________
t/min | 0 | 2 | 5 | 10 | 15 |
n(CO2)/mol | 1 | 0.75 | 0.5 | 0.25 | 0.25 |
(3)下列条件能使上述反应的反应速率增大,且平衡向正反应方向移动的是________(填写序号字母)
a.及时分离出CH3OH气体
b.适当升高温度
c.保持容器的容积不变,再充入1 mol CO2和3 mol H2
d.选择高效催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分析下表中各项的排布规律,按此规律排布第26项应为
1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
C2H4 | C2H6 | C2H6O | C2H6O2 | C3H6 | C3H8 | C3H8O | C3H8O2 | C4H8 | C4H10 |
A.C7H16B.C7H14O2C.C8H18D.C8H18O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,Ksp(CaSO4)=9×10-6,常温下CaSO4在水中的沉淀溶解平衡曲线见图。下列叙述正确的是
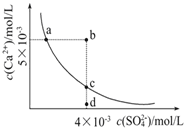
①a、c两点均可以表示CaSO4溶于水所形成的饱和溶液;②a点对应的Ksp不等于c点对应的Ksp;③b点对应的溶液将有沉淀生成;④向d点溶液加入适量的CaCl2固体可以变到c点;⑤d点溶液通过蒸发溶剂可以变到c点;⑥常温下CaSO4溶于水的饱和溶液中,c(Ca2+)与c(SO42-)的乘积对应曲线上任意一点;⑦常温下,向100mL饱和CaSO4溶液中加入400mL0.01mol/L Na2SO4溶液,能使溶液由a点变为b点
A. 2句 B. 3句 C. 4句 D. 5句
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述错误的是
A. 胶体粒子的直径在 1~100 nm 之间 B. 氢氧化铁胶体带正电
C. 可用渗析的方法分离淀粉和氯化钠的混合溶液 D. 胶体能稳定存在的原因是胶粒带电荷
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用如图所示装置和相应试剂能达到实验目的的是( )
选项 | 实验目的 | 试剂a | 试剂b | 试剂c | 装置 |
A | 验证非金属性:S>C>Si | 稀硫酸 | Na2CO3 | Na2SiO3溶液 |
|
B | 制备纯净的NO | 浓硝酸 | Cu | 水 | |
C | 检验溶液X中含有CO32- | 盐酸 | 溶液X | 澄清石灰水 | |
D | 除去Na2SO3中的Na2SO4 | 氯水 | 混合物 | NaOH溶液 |
A. A B. B C. C D. D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com