
【题目】区别下列各组物质,所选择的试剂或方法错误的是( )
A.铁丝和铜丝--观察颜色
B.白酒和白醋--闻气味
C.空气、氮气和氧气--带火星的木条
D.空气和呼出气体--澄清石灰水
 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案科目:高中化学 来源: 题型:
【题目】前四周期元素X、Y、Z、R、Q核电荷数逐渐增加,其中X、Y、Z、R四种元素的核电荷数之和为58;Y 原子的M层p轨道有3个未成对电子;Z与Y同周期,且在该周期中电负性最大;R原子的L层电子数与最外层电子数之比为4∶1,其d轨道中的电子数与最外层电子数之比为5∶2;Q2+的价电子排布式为3d9。
回答下列问题:
(1)R基态原子核外电子的排布式为________。
(2)Z元素的最高价氧化物对应的水化物化学式是___________。
(3)Y、Z分别与X形成最简单共价化合物A、B,A与B相比,稳定性较差的是______(写分子式)。
(4)在Q的硫酸盐溶液中逐滴加入氨水至形成配合物[Q(NH3)4]SO4,现象是_________。不考虑空间结构,配离子[Q(NH3)4]2+的结构可用示意图表示为_____(配位键用→标出)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图,在注射器中加入少量Na2SO3晶体,并吸入少量浓硫酸(以不接触纸条为准)。则下列有关说法正确的是( )
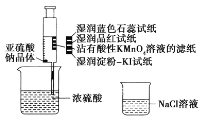
A. 湿润淀粉-KI试纸未变蓝说明SO2的氧化性弱于I2
B. 蓝色石蕊试纸先变红后褪色
C. NaCl溶液可用于除去实验中多余的SO2
D. 品红试纸、沾有酸性KMnO4溶液的滤纸均褪色,证明SO2具有漂白性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】a1、a2分别为A在甲、乙两个恒温容器中建立平衡体系A(g)![]() 2B(g)时的转化率,已知甲容器保持压强不变,乙容器保持容器体积不变。在温度不变的情况下,均增加A的物质的量,下列判断正确的是
2B(g)时的转化率,已知甲容器保持压强不变,乙容器保持容器体积不变。在温度不变的情况下,均增加A的物质的量,下列判断正确的是
A.a1、a2均减小 B.a1减小,a2增大
C.a1不变,a2增大 D.a1不变,a2减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验现象描述正确的是( )
A.镁在空气中燃烧,生成白色固体氧化镁
B.木炭在氧气中燃烧,发出白色火焰,放热,生成黑色固体
C.铜片在空气中加热,观察到铜片表面变黑
D.硫在空气燃烧,发出明亮的蓝紫色火焰,生成一种有刺激性气味的气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示向A中充入1 mol X 、1 mol Y,向B中充入2 mol X、2 mol Y,起始时,
V(A) = V(B) = a L。在相同温度和有催化剂存在下,两容器中各自发生下述反应:X(g)+Y(g)![]() 2Z(g)+W(g) ΔH<0。达到平衡时,V(A) = 1.1a L。(连通管中气体体积不计)下列说法正确的是( )
2Z(g)+W(g) ΔH<0。达到平衡时,V(A) = 1.1a L。(连通管中气体体积不计)下列说法正确的是( )
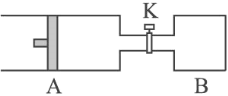
A. n(Z)B = 2n(Z)A
B. A容器中X的转化率为20%
C. 若向A和B中均再加入1molX和1molY,X的体积分数均增大
D. 打开K保持温度不变,又达到平衡时,A的体积为3.3a L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧气是我们身边常见的物质,以下有关氧气的叙述正确的是( )
A.在空气中不能燃烧的物质,在氧气中也不能燃烧
B.鱼、虾等能在水中生存,是由于氧气极易溶于水
C.氧气具有可燃性,可以做燃料
D.物质在氧气中燃烧的反应,不一定是化合反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化碳是导致温室效应的主要气体,其对应的水溶液碳酸是可乐饮料的主要成分之一。回答下列问题:
(1)下列事实中,能证明碳酸是弱酸的是________.
A.碳酸不稳定,易分解为二氧化碳和水
B.用氢氧化钠溶液中和等浓度的碳酸溶液,需要氢氧化钠溶液的体积是碳酸体积的2倍
C.相同条件下,碳酸的导电能力低于相同浓度的硫酸溶液
D.常温下,5.0×10-6mol/L的碳酸溶液pH值为6
(2)煤的燃烧也是导致温室效应的原因之一,其燃烧有下列两种途径:
途径I:C(s)+O2(g)=CO2(g) ΔH=Q1kJ/mol
途径II:先制水煤气:C(s)+H2O(g)=CO(g)+H2(g) ΔH=Q2kJ/mol;再燃烧水煤气:CO(g)+1/2O2(g)=CO2(g) ΔH=Q3kJ/mol;H2(g)+1/2O2(g)=H2O(g) ΔH=Q4kJ/mol则Q1、Q2、Q3、Q4的数学关系式是___________________________________;
(3)常温常压下,空气中的CO2溶于水,达到平衡时,溶液的pH=5.6,c(H2CO3)=1.5×10-5 mol/L。
①向饱和碳酸溶液中分别加入下列物质,能使碳酸的第一步电离平衡向右移动的是_________
A.HCl气体 B.NaOH固体 C.Na单质 D.苯酚钠溶液
②若忽略水的电离及H2CO3的第二级电离,则H2CO3![]() HCO3-+H+的平衡常数K1=_______。(已知:10-5.6=2.5×10-6,保留一位小数);
HCO3-+H+的平衡常数K1=_______。(已知:10-5.6=2.5×10-6,保留一位小数);
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧乙酸(CH3COOOH)是无色透明液体,易溶于水、易挥发,见光易分解,具有强氧化性的高效消毒剂,使用过氧乙酸消毒剂时通常先用水稀释工业品过氧乙酸,然后用喷雾法对空气与地面进行消毒.
(1)配制220mL0.05mol/L的过氧乙酸溶液,需使用的仪器有:烧杯、量筒、玻璃棒及__________________、____________________;
(2)配制过程中,可能引起浓度偏高的操作有__________________
A.容量瓶用蒸馏水洗涤后未干燥,含有少量蒸馏水
B.转移溶液时,不慎有少量溶液洒在容量瓶外
C.定容时,俯视容量瓶刻度线进行定容
D.定容后,把容量瓶倒置摇匀后发现液面低于刻度线,补充几滴水至刻度线
(3)过氧乙酸半小时内会完全分解成乙酸(CH3COOH)和一种常见的气体单质,检验该气体单质的实验方法是_____________________________.
(4)如果生产过氧乙酸的原料CH3COONa中混有了SO42﹣,要想除掉SO42﹣请选择下列试剂按照加入先后顺序填空__________________________________________(试剂不必选完,填序号即可)
①盐酸;②醋酸钡溶液;③氯化钡溶液;④醋酸;⑤碳酸钠溶液;⑥NaHCO3溶液.
(5)制取过氧乙酸反应原理为:H2O2+CH3COOH![]() CH3COOOH(过氧乙酸)+H2O,现称取5.0g用上述方法制取的过氧乙酸试样(液体),稀释至100mL备用.取上述稀释后过氧乙酸试样5.0mL,用0.01mol/L KMnO4溶液以除去其中的H2O2,随即加入10% KI溶液10 mL,摇匀(化学反应方程式为CH3COOOH+2KI=CH3COOK+I2+KOH)再将0.05mol/L Na2S2O3标准溶液加入到上述混合溶液中(化学反应方程式为:I2+2Na2S2O3=2NaI+Na2S4O6),消耗Na2S2O3标准溶液的总体积为20mL.通过计算确定原试样中过氧乙酸的质量分数为____________________.
CH3COOOH(过氧乙酸)+H2O,现称取5.0g用上述方法制取的过氧乙酸试样(液体),稀释至100mL备用.取上述稀释后过氧乙酸试样5.0mL,用0.01mol/L KMnO4溶液以除去其中的H2O2,随即加入10% KI溶液10 mL,摇匀(化学反应方程式为CH3COOOH+2KI=CH3COOK+I2+KOH)再将0.05mol/L Na2S2O3标准溶液加入到上述混合溶液中(化学反应方程式为:I2+2Na2S2O3=2NaI+Na2S4O6),消耗Na2S2O3标准溶液的总体积为20mL.通过计算确定原试样中过氧乙酸的质量分数为____________________.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com