
ЁОЬтФПЁПЙ§бѕввЫс(CH3COOOH)ЪЧЮоЩЋЭИУївКЬх,взШмгкЫЎЁЂвзЛгЗЂ,МћЙтвзЗжНт,ОпгаЧПбѕЛЏадЕФИпаЇЯћЖОМС,ЪЙгУЙ§бѕввЫсЯћЖОМСЪБЭЈГЃЯШгУЫЎЯЁЪЭЙЄвЕЦЗЙ§бѕввЫс,ШЛКѓгУХчЮэЗЈЖдПеЦјгыЕиУцНјааЯћЖО.
(1)ХфжЦ220mL0.05mol/LЕФЙ§бѕввЫсШмвК,ашЪЙгУЕФвЧЦїгаЃКЩеБЁЂСПЭВЁЂВЃСЇАєМА__________________ЁЂ____________________ЃЛ
(2)ХфжЦЙ§ГЬжа,ПЩФмв§Ц№ХЈЖШЦЋИпЕФВйзїга__________________
A.ШнСПЦПгУеєСѓЫЎЯДЕгКѓЮДИЩдя,КЌгаЩйСПеєСѓЫЎ
B.зЊвЦШмвКЪБ,ВЛЩїгаЩйСПШмвКШїдкШнСПЦПЭт
C.ЖЈШнЪБ,ИЉЪгШнСПЦППЬЖШЯпНјааЖЈШн
D.ЖЈШнКѓ,АбШнСПЦПЕЙжУвЁдШКѓЗЂЯжвКУцЕЭгкПЬЖШЯп,ВЙГфМИЕЮЫЎжСПЬЖШЯп
(3)Й§бѕввЫсАыаЁЪБФкЛсЭъШЋЗжНтГЩввЫс(CH3COOH)КЭвЛжжГЃМћЕФЦјЬхЕЅжЪ,МьбщИУЦјЬхЕЅжЪЕФЪЕбщЗНЗЈЪЧ_____________________________.
(4)ШчЙћЩњВњЙ§бѕввЫсЕФдСЯCH3COONaжаЛьгаСЫSO42Љ,вЊЯыГ§ЕєSO42ЉЧыбЁдёЯТСаЪдМСАДееМгШыЯШКѓЫГађЬюПе__________________________________________(ЪдМСВЛБибЁЭъ,ЬюађКХМДПЩ)
ЂйбЮЫсЃЛЂкДзЫсБЕШмвКЃЛЂлТШЛЏБЕШмвКЃЛЂмДзЫсЃЛЂнЬМЫсФЦШмвКЃЛЂоNaHCO3ШмвК.
(5)жЦШЁЙ§бѕввЫсЗДгІдРэЮЊЃКH2O2ЃЋCH3COOH![]() CH3COOOH(Й§бѕввЫс)ЃЋH2O,ЯжГЦШЁ5.0gгУЩЯЪіЗНЗЈжЦШЁЕФЙ§бѕввЫсЪдбљ(вКЬх),ЯЁЪЭжС100mLБИгУ.ШЁЩЯЪіЯЁЪЭКѓЙ§бѕввЫсЪдбљ5.0mL,гУ0.01mol/L KMnO4ШмвКвдГ§ШЅЦфжаЕФH2O2,ЫцМДМгШы10% KIШмвК10 mL,вЁдШ(ЛЏбЇЗДгІЗНГЬЪНЮЊCH3COOOHЃЋ2KIЃНCH3COOKЃЋI2ЃЋKOH)дйНЋ0.05mol/L Na2S2O3БъзМШмвКМгШыЕНЩЯЪіЛьКЯШмвКжа(ЛЏбЇЗДгІЗНГЬЪНЮЊЃКI2ЃЋ2Na2S2O3ЃН2NaIЃЋNa2S4O6),ЯћКФNa2S2O3БъзМШмвКЕФзмЬхЛ§ЮЊ20mL.ЭЈЙ§МЦЫуШЗЖЈдЪдбљжаЙ§бѕввЫсЕФжЪСПЗжЪ§ЮЊ____________________.
CH3COOOH(Й§бѕввЫс)ЃЋH2O,ЯжГЦШЁ5.0gгУЩЯЪіЗНЗЈжЦШЁЕФЙ§бѕввЫсЪдбљ(вКЬх),ЯЁЪЭжС100mLБИгУ.ШЁЩЯЪіЯЁЪЭКѓЙ§бѕввЫсЪдбљ5.0mL,гУ0.01mol/L KMnO4ШмвКвдГ§ШЅЦфжаЕФH2O2,ЫцМДМгШы10% KIШмвК10 mL,вЁдШ(ЛЏбЇЗДгІЗНГЬЪНЮЊCH3COOOHЃЋ2KIЃНCH3COOKЃЋI2ЃЋKOH)дйНЋ0.05mol/L Na2S2O3БъзМШмвКМгШыЕНЩЯЪіЛьКЯШмвКжа(ЛЏбЇЗДгІЗНГЬЪНЮЊЃКI2ЃЋ2Na2S2O3ЃН2NaIЃЋNa2S4O6),ЯћКФNa2S2O3БъзМШмвКЕФзмЬхЛ§ЮЊ20mL.ЭЈЙ§МЦЫуШЗЖЈдЪдбљжаЙ§бѕввЫсЕФжЪСПЗжЪ§ЮЊ____________________.
ЁОД№АИЁП250mLШнСПЦП НКЭЗЕЮЙм C гУДјЛ№аЧЕФФОЙїНгДЅЦјЬх,ЙлВьЪЧЗёИДШМ ЂкЂнЂм 15.2%
ЁОНтЮіЁП
(1)ИљОнХфжЦВНжшЪЧМЦЫуЁЂСПШЁЁЂЯЁЪЭЁЂРфШДЁЂвЦвКЁЂЯДЕгЁЂЖЈШнЁЂвЁдШЁЂзАЦПРДЗжЮіашвЊЕФвЧЦїЃЛ
(2)ИљОнc=![]() ВЂНсКЯШмжЪЕФЮяжЪЕФСПnКЭШмвКЕФЬхЛ§VЕФБфЛЏРДНјааЮѓВюЗжЮіЃЛ
ВЂНсКЯШмжЪЕФЮяжЪЕФСПnКЭШмвКЕФЬхЛ§VЕФБфЛЏРДНјааЮѓВюЗжЮіЃЛ
(3) Й§бѕввЫсФмЗжНтЮЊввЫсКЭбѕЦјЃЌИљОнбѕЦјФмЪЙДјЛ№аЧЕФФОЬѕИДШМРДЗжЮіЃЛ
(4)Г§ШЅCH3COONaжаЛьгаСЫSO42ЉЃЌгІМгШыЙ§СПЕФДзЫсБЕЃЌШЛКѓМгЬМЫсФЦГ§ШЅЙ§СПЕФБЕРызгЃЌзюКѓМгДзЫсГ§ШЅЙ§СПЕФЬМЫсИљМДПЩЃЛ
(5)ИљОнCH3COOOHЃЋ2KIЃНCH3COOKЃЋI2ЃЋKOHМАI2ЃЋ2Na2S2O3ЃН2NaIЃЋNa2S4O6СНИіЛЏбЇЗНГЬЪНЃЌПЩвдЕУЙиЯЕЪНШчЯТЃКCH3COOOHЁЋI2ЁЋ2 Na2S2O3ЃЌОнДЫМЦЫуЯЁЪЭКѓ5mLЗДгІжаnЃЈCH3COOOHЃЉЃЌНјЖјМЦЫудЪдбљжаЙ§бѕввЫсЕФжЪСПЗжЪ§ЁЃ
(1)ИљОнХфжЦВНжшЪЧМЦЫуЁЂСПШЁЁЂЯЁЪЭЁЂРфШДЁЂвЦвКЁЂЯДЕгЁЂЖЈШнЁЂвЁдШЁЂзАЦППЩвджЊЕРЫљашЕФвЧЦїгаСПЭВЁЂЩеБЁЂВЃСЇАєЁЂ250mLШнСПЦПКЭНКЭЗЕЮЙмЃЌЙЪГ§СЫЩеБЁЂСПЭВЁЂВЃСЇАєЭтЃЌЛЙашвЊ250mLШнСПЦПЁЂНКЭЗЕЮЙмЃЌ
вђДЫЃЌБОЬте§ШЗД№АИЪЧЃК250mLШнСПЦПЃЛНКЭЗЕЮЙмЃЛ
(2)A.ШнСПЦПгУеєСѓЫЎЯДЕгКѓЮДИЩдяЃЌКЌгаЩйСПеєСѓЫЎЖдЫљХфШмвКЕФХЈЖШЮогАЯьЃЌЙЪAДэЮѓЃЛ
B.зЊвЦШмвКЪБЃЌВЛЩїгаЩйСПШмвКШїдкШнСПЦПЭтЃЌЛсдьГЩШмжЪЕФЫ№ЪЇЃЌдђХЈЖШЦЋЕЭЃЌЙЪBДэЮѓЃЛ
C.ЖЈШнЪБЃЌИЉЪгШнСПЦППЬЖШЯпНјааЖЈШнЃЌдђШмвКЬхЛ§ЦЋаЁЃЌХЈЖШЦЋИпЃЌЫљвдCбЁЯюЪЧе§ШЗЕФЃЛ
D.ЖЈШнКѓЃЌАбШнСПЦПЕЙжУвЁдШКѓЗЂЯжвКУцЕЭгкПЬЖШЯпЪЧе§ГЃЕФЃЌВЛБиВЙГфМИЕЮЫЎжСПЬЖШЯпЃЌШєВЙГфСЫЃЌдђХЈЖШЦЋЕЭЃЌЙЪDДэЮѓЁЃ
вђДЫЃЌБОЬте§ШЗД№АИЪЧЃКCЃЛ
(3) Й§бѕввЫсФмЗжНтЮЊввЫсКЭбѕЦјЃЌЖјбѕЦјФмЪЙДјЛ№аЧЕФФОЬѕИДШМЃЌЙЪМьбщбѕЦјЕФЗНЗЈЮЊгУДјЛ№аЧЕФФОЙїНгДЅЦјЬхЃЌЙлВьЪЧЗёИДШМЃЛ
вђДЫЃЌБОЬте§ШЗД№АИЪЧЃКгУДјЛ№аЧЕФФОЙїНгДЅЦјЬхЃЌЙлВьЪЧЗёИДШМЃЛ
(4)Г§ШЅCH3COONaжаЛьгаСЫSO42ЉЃЌгІМгШыБЕбЮЃЌв§ШыБЕРызгЃЌЖјДгВЛвЊв§ШыаТдгжЪЕФНЧЖШРДЗжЮіЃЌгІМгШыЙ§СПЕФДзЫсБЕЃЛШЛКѓМгЙ§СПЕФЬМЫсФЦГ§ШЅЙ§СПЕФБЕРызгЃЌзюКѓМгДзЫсГ§ШЅЙ§СПЕФЬМЫсИљМДПЩЃЌ
вђДЫЃЌБОЬте§ШЗД№АИЪЧЃКЂкЂнЂмЃЛ
(5)ИљОнCH3COOOHЃЋ2KIЃНCH3COOKЃЋI2ЃЋKOHМАI2ЃЋ2Na2S2O3ЃН2NaIЃЋNa2S4O6СНИіЛЏбЇЗНГЬЪНЃЌПЩвдЕУЙиЯЕЪНШчЯТЃКCH3COOOHЁЋI2ЁЋ2 Na2S2O3ЃЌгЩЙиЯЕЪНПЩжЊЃЌnЃЈCH3COOOHЃЉ=![]() nЃЈNa2S2O3ЃЉ=
nЃЈNa2S2O3ЃЉ=![]() ЁС0.05mol/LЁС0.02L=5ЁС10-4molЃЌ
ЁС0.05mol/LЁС0.02L=5ЁС10-4molЃЌ
ЙЪдбљЦЗжаwЃЈCH3COOOHЃЉ=![]() 100%=15.2%ЃЌ
100%=15.2%ЃЌ
вђДЫЃЌБОЬте§ШЗД№АИЪЧЃК15.2%ЃЎ


 УћЪІЕуОІзжДЪОфЖЮЦЊЯЕСаД№АИ
УћЪІЕуОІзжДЪОфЖЮЦЊЯЕСаД№АИ
| ФъМЖ | ИпжаПЮГЬ | ФъМЖ | ГѕжаПЮГЬ |
| ИпвЛ | ИпвЛУтЗбПЮГЬЭЦМіЃЁ | ГѕвЛ | ГѕвЛУтЗбПЮГЬЭЦМіЃЁ |
| ИпЖў | ИпЖўУтЗбПЮГЬЭЦМіЃЁ | ГѕЖў | ГѕЖўУтЗбПЮГЬЭЦМіЃЁ |
| ИпШ§ | ИпШ§УтЗбПЮГЬЭЦМіЃЁ | ГѕШ§ | ГѕШ§УтЗбПЮГЬЭЦМіЃЁ |
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЧјБ№ЯТСаИїзщЮяжЪЃЌЫљбЁдёЕФЪдМСЛђЗНЗЈДэЮѓЕФЪЧЃЈ ЃЉ
A.ЬњЫПКЭЭЫП--ЙлВьбеЩЋ
B.АзОЦКЭАзДз--ЮХЦјЮЖ
C.ПеЦјЁЂЕЊЦјКЭбѕЦј--ДјЛ№аЧЕФФОЬѕ
D.ПеЦјКЭКєГіЦјЬх--ГЮЧхЪЏЛвЫЎ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯТСаа№ЪіДэЮѓЕФЪЧ
A. НКЬхСЃзгЕФжБОЖдк 1ЁЋ100 nm жЎМф B. ЧтбѕЛЏЬњНКЬхДје§Еч
C. ПЩгУЩјЮіЕФЗНЗЈЗжРыЕэЗлКЭТШЛЏФЦЕФЛьКЯШмвК D. НКЬхФмЮШЖЈДцдкЕФдвђЪЧНКСЃДјЕчКЩ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПгУШчЭМЫљЪОзАжУКЭЯргІЪдМСФмДяЕНЪЕбщФПЕФЕФЪЧЃЈ ЃЉ
бЁЯю | ЪЕбщФПЕФ | ЪдМСa | ЪдМСb | ЪдМСc | зАжУ |
A | бщжЄЗЧН№Ъєад:S>C>Si | ЯЁСђЫс | Na2CO3 | Na2SiO3ШмвК |
|
B | жЦБИДПОЛЕФNO | ХЈЯѕЫс | Cu | ЫЎ | |
C | МьбщШмвКXжаКЌгаCO32- | бЮЫс | ШмвКX | ГЮЧхЪЏЛвЫЎ | |
D | Г§ШЅNa2SO3жаЕФNa2SO4 | ТШЫЎ | ЛьКЯЮя | NaOHШмвК |
A. A B. B C. C D. D
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯТСаЫЕЗЈе§ШЗЕФЪЧЃЈ ЃЉ
A. ВтЖЈHClКЭNaOHжаКЭЗДгІЕФЗДгІШШЪБЃЌЕЅДЮЪЕбщОљгІВтСП3ИіЮТЖШЃЌМДбЮЫсЦ№ЪМЮТЖШЁЂNaOHШмвКЦ№ЪМЮТЖШКЭЗДгІжежЙЮТЖШ
B. Шє2C(s)+O2(g)=2CO(g)ЁїH=-221.0 kJ/molЃЌдђЬМЕФШМЩеШШЮЊ110.5 kJ/mol
C. ашвЊМгШШЕФЗДгІвЛЖЈЪЧЮќШШЗДгІ,ГЃЮТЯТФмЗЂЩњЕФЗДгІвЛЖЈЪЧЗХШШЗДгІ
D. вбжЊIЃКЗДгІH2(g)+Cl2(g)ЃН2HCl(g)ЃЛЁїH=-a kJ/mol
II: ![]()
ЧвaЁЂbЁЂcОљДѓгкСуЃЌдђЖЯПЊ1molH-ClМќЫљашЕФФмСПЮЊ2(a+b+c)kJ/mol
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯТСаа№ЪіДэЮѓЕФЪЧЃЈ ЃЉ
A.ДјЯрЗДЕчКЩРызгжЎМфЕФЯрЛЅзїгУГЦЮЊРызгМќ
B.Н№ЪєдЊЫигыЗЧН№ЪєдЊЫиЛЏКЯЪБЃЌВЛвЛЖЈаЮГЩРызгМќ
C.ФГдЊЫиЕФдзгзюЭтВужЛгавЛИіЕчзгЃЌЫќИњТБЫиНсКЯЪБЫљаЮГЩЕФЛЏбЇМќВЛвЛЖЈЪЧРызгМќ
D.ЗЧН№ЪєдЊЫидзгМфВЛПЩФмаЮГЩРызгМќ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯТСаЪЕбщвЧЦїПЩвджБНггУРДМгШШЕФЪЧ
A. ШнСПЦП B. ЪдЙм C. зЖаЮЦП D. СПЭВ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯТСаЮяжЪЕФБЃДцЗНЗЈВЛе§ШЗЕФЪЧ
A.аТжЦТШЫЎгІУмЗтБЃДцB.ЪЂвКфхЕФЪдМСЦПГЃМгЩйСПЫЎ
C.ЩйСПЕФН№ЪєФЦгІБЃДцдкУКгЭжаD.ЙЬЬЌЕтЗХдкзиЩЋЯИПкЦПжа
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПСђДњСђЫсФЦ(Na2S2O3)дкЩњВњЩњЛюжаОпгаЙуЗКгІгУЁЃЛиД№ЯТСаЮЪЬтЃК
I.ЙЄвЕЩЯЦеБщЪЙгУNa2SO3гыСђЛЧЙВжѓжЦБИNa2S2O3ЃЌзАжУШчЭМ1ЁЃ
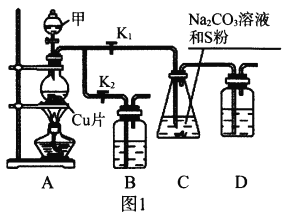
ЃЈ1ЃЉДђПЊK1ЙиБеK2ЃЌЯђдВЕзЩеЦПжаМгШызуСПЪдМСМзВЂМгШШЁЃЪдМСМзЮЊ_________ЃЌзАжУBКЭDЕФзїгУЪЧ_________ЁЃ
ЃЈ2ЃЉЪМжеБЃГжCжаШмвКГЪМюадЁЂМгШШВњЩњNa2S2O3ЃЌЗДгІЕФЛЏбЇЗНГЬЪНЮЊ___________________________ЁЃЗДгІвЛЖЮЪБМфКѓЃЌCжаСђЗлж№НЅМѕЩйЃЌМАЪБДђПЊK2ЁЂЙиБеK1ВЂЭЃжЙМгШШЃЌНЋCжаЫљЕУЛьКЯЮяЗжРыЬсДПКѓМДЕУЕНNa2S2O3ЁЃШєВЛМАЪБЙиБеK1ЃЌНЋЕМжТCжаШмвКГЪЫсадЁЂЗЂЩњИБЗДгІВњЩњSКЭ_________ЁЃ
Ђђ.РћгУSO2гыNa2CO3ЁЂNa2SЕФЛьКЯШмвКЗДгІвВФмжЦБИNa2S2O3ЃЌЫљашвЧЦїШчЭМ2ЁЃ

ЃЈ1ЃЉзАжУGжаNa2CO3гыNa2SЕФзюМбЮяжЪЕФСПжЎБШЮЊ_________ЁЃ
ЃЈ2ЃЉДгзѓЕНгвСЌНгИївЧЦїЃЌНгПкЫГађЮЊЃК_________НгgЁЂhНг_________ЁЂ_________Нг_________ЁЂ_________НгdЁЃ
Ђѓ.ГЃгУNa2S2O3ШмвКВтЖЈЗЯЫЎжаBa2+ХЈЖШЁЃ
ШЁЗЯЫЎ20.00mLЃЌПижЦЪЪЕБЕФЫсЖШМгШызуСПK2Cr2O7ШмвКЃЌЕУ BaCrO4ГСЕэЃЛЙ§ТЫЯДЕгКѓгУЪЪСПЯЁЫсШмНтЃЌДЫЪБCrO42ЃШЋВПзЊЛЏЮЊCr2O72ЃЃЛдйМгЙ§СПKIШмвКЃЌНЋCr2O72ЃГфЗжЗДгІЃКCr2O72Ѓ+6IЃ+14H+=3I2+2Cr3++7H2OЁЃШЛКѓМгШыЕэЗлШмвКзїжИЪОМСЃЌгУ0.0100mol/LЕФNa2S2O3ШмвКНјааЕЮЖЈЃКI2+2S2O32Ѓ===S4O62Ѓ+2IЃЁЃЕБШмвК_________МДЮЊжеЕуЁЃЦНааЕЮЖЈ3ДЮЃЌЯћКФNa2S2O3ШмвКЕФЦНОљгУСПЮЊ18.00mЃЌдђИУЗЯЫЎжаBa2+ЕФЮяжЪЕФСПХЈЖШЮЊ_________ЁЃ
ВщПДД№АИКЭНтЮі>>
ЙњМЪбЇаЃгХбЁ - СЗЯАВсСаБэ - ЪдЬтСаБэ
КўББЪЁЛЅСЊЭјЮЅЗЈКЭВЛСМаХЯЂОйБЈЦНЬЈ | ЭјЩЯгаКІаХЯЂОйБЈзЈЧј | ЕчаХеЉЦОйБЈзЈЧј | ЩцРњЪЗащЮожївхгаКІаХЯЂОйБЈзЈЧј | ЩцЦѓЧжШЈОйБЈзЈЧј
ЮЅЗЈКЭВЛСМаХЯЂОйБЈЕчЛАЃК027-86699610 ОйБЈгЪЯфЃК58377363@163.com