
【题目】硫代硫酸钠(Na2S2O3)在生产生活中具有广泛应用。回答下列问题:
I.工业上普遍使用Na2SO3与硫磺共煮制备Na2S2O3,装置如图1。
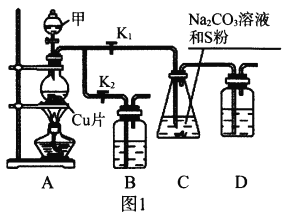
(1)打开K1关闭K2,向圆底烧瓶中加入足量试剂甲并加热。试剂甲为_________,装置B和D的作用是_________。
(2)始终保持C中溶液呈碱性、加热产生Na2S2O3,反应的化学方程式为___________________________。反应一段时间后,C中硫粉逐渐减少,及时打开K2、关闭K1并停止加热,将C中所得混合物分离提纯后即得到Na2S2O3。若不及时关闭K1,将导致C中溶液呈酸性、发生副反应产生S和_________。
Ⅱ.利用SO2与Na2CO3、Na2S的混合溶液反应也能制备Na2S2O3,所需仪器如图2。

(1)装置G中Na2CO3与Na2S的最佳物质的量之比为_________。
(2)从左到右连接各仪器,接口顺序为:_________接g、h接_________、_________接_________、_________接d。
Ⅲ.常用Na2S2O3溶液测定废水中Ba2+浓度。
取废水20.00mL,控制适当的酸度加入足量K2Cr2O7溶液,得 BaCrO4沉淀;过滤洗涤后用适量稀酸溶解,此时CrO42-全部转化为Cr2O72-;再加过量KI溶液,将Cr2O72-充分反应:Cr2O72-+6I-+14H+=3I2+2Cr3++7H2O。然后加入淀粉溶液作指示剂,用0.0100mol/L的Na2S2O3溶液进行滴定:I2+2S2O32-===S4O62-+2I-。当溶液_________即为终点。平行滴定3次,消耗Na2S2O3溶液的平均用量为18.00m,则该废水中Ba2+的物质的量浓度为_________。
【答案】浓硫酸 吸收SO2,防止污染空气 S+SO2+Na2CO3![]() Na2S2O3+CO2 NaHSO3 1:2 a b c e f 蓝色褪去且在半分钟内不恢复 0.00300mol/L
Na2S2O3+CO2 NaHSO3 1:2 a b c e f 蓝色褪去且在半分钟内不恢复 0.00300mol/L
【解析】
I.(1)A为二氧化硫的制备装置,C制取Na2S2O3,二氧化硫有毒,装置B和D中需盛碱液(如NaOH溶液),用于吸收SO2,防止污染空气。
Ⅱ.(1)装置G中Na2CO3与Na2S的最佳物质的量之比由反应方程式中化学计量数之比确定;
(2)按I(实验后期关闭K1,打开K2可吸收多余SO2)→H(制取SO2)→E(安全装置)→G(制取Na2S2O3)→F(吸收SO2尾气)确定连接装置的顺序。
Ⅲ.碘遇到淀粉呈蓝色,终点为蓝色褪去且在半分钟内不恢复;
按关系式:2Ba2+~2BaCrO4~Cr2O72-~3I2 ~6S2O32-计算n(Ba2+),再由C=n/V计算浓度。
I.(1)A为二氧化硫的制备装置,故试剂甲为浓硫酸,装置B和D中需盛碱液(如NaOH溶液),用于吸收SO2,防止污染空气。
(2)C中反应物SO2、Na2CO3溶液和硫粉,根据题意首先SO2和Na2CO3溶液发生反应生成Na2SO3和CO2,Na2SO3和S制Na2S2O3,总反应为:S+SO2+Na2CO3![]() Na2S2O3+CO2;
Na2S2O3+CO2;
若不及时关闭K1,将导致C中溶液呈酸性而发生副反应Na2S2O3+SO2+H2O=2NaHSO3+S↓。
Ⅱ(1)装置G中发生反应的方程式为:Na2CO3+2Na2S+4SO2=3Na2S2O3+CO2,故Na2CO3和Na2S的最佳物质的量之比为1:2。
(2)需按下列顺序连接装置,I(实验后期关闭K1,打开K2可吸收多余SO2)→H(制取SO2)→E(安全装置)→G(制取Na2S2O3)→F(吸收SO2尾气),所以各接口的顺序为:a接g、h接b、c接e、f接d。
Ⅲ向碘的淀粉蓝色溶液中滴加Na2S2O3溶液,滴定终点为蓝色褪去且在半分钟内不恢复。
相关物质转化的关系式为:2Ba2+~2BaCrO4~Cr2O72-~3I2 ~6S2O32-,n(Ba2+)=n(S2O32-)/3=18.00mL×0.0100mol/L/3=0.06mmol,c(Ba2+)=0.06mmol/20.00mL=0.00300mol/L


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】过氧乙酸(CH3COOOH)是无色透明液体,易溶于水、易挥发,见光易分解,具有强氧化性的高效消毒剂,使用过氧乙酸消毒剂时通常先用水稀释工业品过氧乙酸,然后用喷雾法对空气与地面进行消毒.
(1)配制220mL0.05mol/L的过氧乙酸溶液,需使用的仪器有:烧杯、量筒、玻璃棒及__________________、____________________;
(2)配制过程中,可能引起浓度偏高的操作有__________________
A.容量瓶用蒸馏水洗涤后未干燥,含有少量蒸馏水
B.转移溶液时,不慎有少量溶液洒在容量瓶外
C.定容时,俯视容量瓶刻度线进行定容
D.定容后,把容量瓶倒置摇匀后发现液面低于刻度线,补充几滴水至刻度线
(3)过氧乙酸半小时内会完全分解成乙酸(CH3COOH)和一种常见的气体单质,检验该气体单质的实验方法是_____________________________.
(4)如果生产过氧乙酸的原料CH3COONa中混有了SO42﹣,要想除掉SO42﹣请选择下列试剂按照加入先后顺序填空__________________________________________(试剂不必选完,填序号即可)
①盐酸;②醋酸钡溶液;③氯化钡溶液;④醋酸;⑤碳酸钠溶液;⑥NaHCO3溶液.
(5)制取过氧乙酸反应原理为:H2O2+CH3COOH![]() CH3COOOH(过氧乙酸)+H2O,现称取5.0g用上述方法制取的过氧乙酸试样(液体),稀释至100mL备用.取上述稀释后过氧乙酸试样5.0mL,用0.01mol/L KMnO4溶液以除去其中的H2O2,随即加入10% KI溶液10 mL,摇匀(化学反应方程式为CH3COOOH+2KI=CH3COOK+I2+KOH)再将0.05mol/L Na2S2O3标准溶液加入到上述混合溶液中(化学反应方程式为:I2+2Na2S2O3=2NaI+Na2S4O6),消耗Na2S2O3标准溶液的总体积为20mL.通过计算确定原试样中过氧乙酸的质量分数为____________________.
CH3COOOH(过氧乙酸)+H2O,现称取5.0g用上述方法制取的过氧乙酸试样(液体),稀释至100mL备用.取上述稀释后过氧乙酸试样5.0mL,用0.01mol/L KMnO4溶液以除去其中的H2O2,随即加入10% KI溶液10 mL,摇匀(化学反应方程式为CH3COOOH+2KI=CH3COOK+I2+KOH)再将0.05mol/L Na2S2O3标准溶液加入到上述混合溶液中(化学反应方程式为:I2+2Na2S2O3=2NaI+Na2S4O6),消耗Na2S2O3标准溶液的总体积为20mL.通过计算确定原试样中过氧乙酸的质量分数为____________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物X是一种香料,可采用乙烯与甲苯为主要原料,按下列路线合成:
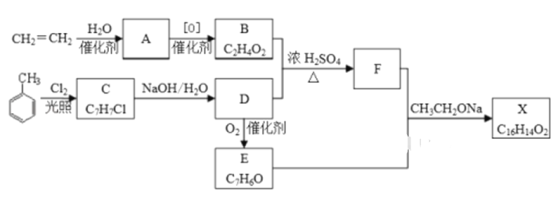
已知:RX![]() ROH;RCHO+CH3COOR′
ROH;RCHO+CH3COOR′![]() RCH=CHCOOR′
RCH=CHCOOR′
请回答:
(1)C 的结构简式________________ ,A中官能团的名称是__________
(2)B+D→F的化学方程式___________________________,其反应类型为_____________
(3)X的结构简式___________________
(4)D→E的化学方程式____________________________________
(5)F有多种同分异构体,符合下列条件的同分异构体数目有______种,请写出其中一种同分异构体的结构简式________
①是苯的二元取代物
②能发生水解及银镜反应
③核磁共振氢谱有5个吸收峰,峰面积之比为3:2:2:2:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含碘食盐中的碘是以碘酸钾(KIO3)形式存在的。已知在酸性溶液中IO3-和I-发生下列反应IO3-+5I-+6H+=3I2+3H2O。现有下列物质 ①稀硫酸;②pH试纸;③淀粉碘化钾溶液;④淀粉溶液。利用上述反应,可用来检验含碘食盐中含有IO3-的是
A.①③B.②③C.①④D.②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中科院深圳先进技术研究院成功研发了一种高效低成本储能电池——“铝一石墨”双离子电池,电池总反应为Al+xC+Li++PF6 -![]() AlLi+Cx PF6下列有关该电池的说法正确的是
AlLi+Cx PF6下列有关该电池的说法正确的是
A. 放电时,PF6-向正极移动
B. 放电时,负极反应为A1-3e-====Al3+
C. 充电时,两个电极增加的质量相等
D. 充电时,阳极反应为xC+PF6--e-==CxPF6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求写热化学方程式:
(1)已知稀溶液中,1 mol H2SO4与NaOH溶液恰好完全反应时,放出114.6 kJ热量,写出表示H2SO4与NaOH反应的中和热的热化学方程式__________。
(2)已知在25℃、101kPa下,1 g乙醇在氧气中充分燃烧生成二氧化碳和液态水释放出29.7 kJ的热量,试写出乙醇燃烧热的热化学方程式_______________。
(3)标准状况下,4.48L H2在足量O2中完全燃烧放出热量Q kJ,写出H2燃烧的热化学方程式_________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是人们开发和利用的一种新能源。
已知①2H2(g)+O2(g)===2H2O(l)ΔH1=-571.8 kJ/mol;
②CH3OH(g)+1/2O2(g)===CO2(g)+2H2(g)ΔH2=-192.9 kJ/mol。
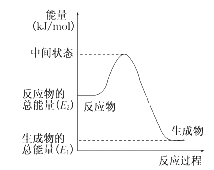
(1)甲醇蒸气完全燃烧的热化学反应方程式_______。
(2)反应②中的能量变化如图所示,则ΔH2=________ kJ/mol(用E1、E2表示)。
(3)H2(g)的燃烧热为________,分析H2(g)作为能源比甲醇蒸气作为能源的优点:_____(写出两点即可)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种燃料电池中发生的化学反应为:在酸性溶液中甲醇与氧作用生成水和二氧化碳。该电池负极发生的反应是
A.CH3OH(g)+O2(g)=H2O(1)+CO2(g)+2H+(aq)+2e-
B.O2(g)+4H+(aq)+4e-=2H2O(1)
C.CH3OH(g)+H2O(1)-6e-=CO2(g)+6H+(aq)
D.O2(g)+2H2O(1)+4e-=4OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】pH=2的A、B两种酸溶液各1 mL,分别加水稀释到1 000 mL,其pH与溶液体积V的关系如图所示。

下列说法正确的是( )
A. A、B两酸溶液的物质的量浓度一定相等
B. 稀释后,A酸溶液的酸性比B酸溶液强
C. a=5时,A是强酸,B是弱酸
D. 若A、B都是弱酸,则5≥a>2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com