
【题目】在盛有足量M的体积可变的密闭容器中加入N,发生反应:M (s)+2N (g)═4P (s)+Q(g)△H<0.在一定温度、压强下达到平衡,平衡时P的物质的量与起始时加入N的物质的量的转化关系如图所示.下列说法正确的是( )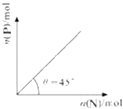
A.平衡时N的转化率为50%
B.当温度升高后,则图中θ>45°
C.若再加入N,则正、逆反应速率均逐渐增大
D.若在加入N,则反应体系中气体密度减小
【答案】A
【解析】解:A、根据图象结合方程式知,加入的N物质的物质的量与生成P物质的物质的量相等,所以该反应中有一半的N物质反应,所以其转化率为50%,故A正确;
B、反应为放热反应,升温平衡逆向移动,则P的物质的量减少,由图可以看出,图中θ<45°,故B错误;
C、因体积可变,再加入N,容器体积增大,Q浓度减小,逆反应速率减慢,故C错误;
D、根据图象结合方程式知,加入的N物质的物质的量与生成P物质的物质的量相等,所以该反应中有一半的N物质反应.
假设加入的N物质是nmol,其中有一半的N参加反应.
M(s)+2N(g)4P(s)+Q(g)
1 2 4 1![]() nmol
nmol ![]() nmol nmol
nmol nmol ![]() nmol
nmol
设M的摩尔质量和N的摩尔质量为MA、MB .
达平衡时,混合气体的ρ= ![]() =
= ![]() =
= ![]() .
.
根据密度公式知,气体的密度与加入N的多少无关,只要温度压强不变,气体摩尔体积不变,所以若再加入N,则再次达到平衡时反应体系气体密度始终不变,故D错误;
故选A.
【考点精析】本题主要考查了化学平衡状态本质及特征的相关知识点,需要掌握化学平衡状态的特征:“等”即 V正=V逆>0;“动”即是动态平衡,平衡时反应仍在进行;“定”即反应混合物中各组分百分含量不变;“变”即条件改变,平衡被打破,并在新的条件下建立新的化学平衡;与途径无关,外界条件不变,可逆反应无论是从正反应开始,还是从逆反应开始,都可建立同一平衡状态(等效)才能正确解答此题.


 字词句段篇系列答案
字词句段篇系列答案科目:高中化学 来源: 题型:
【题目】1,4﹣戊二烯和X是有机合成的基础原料,用下列方法可以合成F如图1. 

(1)已知C与新制的氢氧化铜共热生成红色沉淀;X是分子中所有原子共平面的烃.则X的结构简式为 , X在一定条件下生成的高分子化合物的结构简式为 .
(2)①的反应类型是 , F中所含官能团的名称是 .
(3)1,4﹣戊二烯最多共面的碳原子数为 , 它的一种同分异构体为 ![]() ,该有机物的系统命名为 .
,该有机物的系统命名为 .
(4)与B互为同分异构体的T是有机合成的中间体,它的核磁共振氢谱如图2所示.则T的结构简式为 .
(5)反应②的化学方程式为 , 反应⑤生成物中除水外的无机物的化学式是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】W,X,Y,Z均为原子序数依次增大的短周期主族元素,W,X,Y处于同一周期,W元素形成的化合物种类最多,W和Y族序数之和为X族序数的2倍,Z的最高价氧化物对应的水化物既能溶于酸又能溶于碱,下列说法中正确的是( )
A.简单气态氢化物沸点Y>X>W
B.原子半径Z>Y>X>W
C.Y元素可能位于第二周期第ⅦA族
D.Y元素与其它三种元素均可形成多种化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式中,属于水解反应的是( )
A. HCOOH+H2O![]() HCOO— + H3O+ B. CO2+H2O
HCOO— + H3O+ B. CO2+H2O![]() HCO3— + H+
HCO3— + H+
C. SO32— + H2O![]() HSO3— + OH— D. HS— + H2O
HSO3— + OH— D. HS— + H2O![]() S2— + H3O+
S2— + H3O+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用乙炔为原料制取CH2Br—CHBrCl,可行的反应途径是( )
A.先加Cl2 , 再加Br2
B.先加Cl2 , 再加HBr
C.先加HCl,再加HBr
D.先加HCl,再加Br2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图为氢氧燃料电池原理示意图,按照此图的提示,回答以下问题: 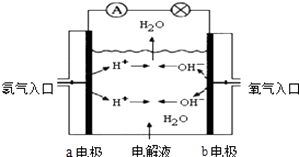
(1)下列叙述不正确的是 A a电极是负极
B b电极的电极反应为:4OH﹣﹣4e﹣=2H2O+O2↑
C 氢氧燃料电池是一种具有应用前景的绿色电源
D 氢氧燃料电池是一种不需要将还原剂和氧化剂全部储藏在电池内的新型发电装置
(2)若电解质溶液为KOH溶液,则电极反应式为:a极b极
(3)若电解质溶液为稀H2SO4 , 则电极反应式为:a极b极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锂空气电池比锂离子电池具有更高的能量密度,前景非常广阔,其结构及工作原理如图(固体电解液只允许Li+通过),下列有关说法不正确的是( ) 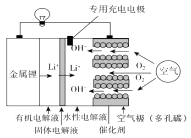
A.电池工作时,正极反应式:O2+2H2O+4e﹣=4OH﹣
B.去掉固体电解液和有机电解质,电池反应发生改变
C.充电时,生成14 g Li,空气极质量增加16 g
D.充电时,专用充电电极可以有效防止空气极腐蚀和劣化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是( )
A.烧碱溶液与小苏打溶液反应:OH﹣+HCO ![]() ═H2O+CO2↑
═H2O+CO2↑
B.碳酸钙溶于醋酸:CaCO3+2H+═Ca2++H2O+CO2
C.向H2O中加入少量Na2O2 , 产生无色气体:2Na2O2+2H2O═O2↑+4OH﹣+4Na+
D.向Cl2水中滴入适量FeCl2 溶液,溶液变为黄色:Fe2++Cl2═Fe3++2Cl﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是向10mLAgNO3溶液中逐渐加入0.1mol/L的NaCl溶液时,溶液的pAg随着加入NaCl溶液的体积(单位mL)变化的图象(实线).已知:pAg=﹣lg{c(Ag+)},Ksp(AgCl)=1×10﹣12 . 根据图象所得下列结论正确的是( )(提示:Ksp(AgCl)>Ksp(AgI)) 
A.原AgNO3溶液的物质的量浓度为0.1 molL﹣1
B.图中x点的坐标为(100,6 )
C.图中x点可认为溶液中Ag+被沉淀完全
D.把0.1 molL﹣1的NaCl换成0.1 molL﹣1NaI则图象在终点后变为虚线部分
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com