
| A. | 1 mo1•L-1的 Ca(ClO)2溶液中含ClO-数目小于2NA | |
| B. | 1 mo1 N2和3 mol H2在密闭容器中充分反应后,容器中含有 N-H键数为6NA | |
| C. | 1 mol乙烯和乙醇气体的混合物完全燃烧,消耗的氧分子数为3NA | |
| D. | 标准状况下,2.24 L35Cl2中含有的中子数为3.4NA |
分析 A、溶液体积不明确;
B、合成氨的反应为可逆反应;
C、1mol乙烯和1mol乙醇燃烧均消耗3mol氧气;
D、求出35Cl2的物质的量,然后根据1mol35Cl2中含36mol中子来分析.
解答 解:A、溶液体积不明确,故溶液中的次氯酸根的个数无法计算,故A错误;
B、合成氨的反应为可逆反应,不能进行彻底,故生成的N-H键的个数小于6NA个,故B错误;
C、1mol乙烯和1mol乙醇燃烧均消耗3mol氧气,故1mol乙烯和乙醇的混合物完全燃烧消耗3mol氧气即3NA个氧气分子,故C正确;
D、标况下2.24L35Cl2的物质的量为0.1mol,而1mol35Cl2中含36mol中子,故0.1mol氯气中含3.6NA个中子,故D错误.
故选C.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.


科目:高中化学 来源: 题型:解答题
 某校化学兴趣小组采用酸碱中和滴定法用0.1000mol/LNaOH溶液滴定待测盐酸溶液,试回答下面的问题:
某校化学兴趣小组采用酸碱中和滴定法用0.1000mol/LNaOH溶液滴定待测盐酸溶液,试回答下面的问题:查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,2.24L戊烷中存在的共价键总数为1.6NA | |
| B. | 23gNO2与N2O4的混合气体中含有的氮原子数为0.5NA | |
| C. | 过氧化钠与二氧化碳反应时,生成0.1mol氧气转移的电子数为0.4NA | |
| D. | 1L0.1mol•L-1的NaH2PO4溶液中H2PO4-、HPO42-和PO43-离子数之和为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

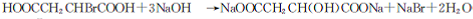 .
. +(n-1)H2O→n HOOCCH2CH(OH)COOH.
+(n-1)H2O→n HOOCCH2CH(OH)COOH.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化学键可以使离子相结合,也可以使原子相结合 | |
| B. | 非金属元素的原子之间只能形成共价键 | |
| C. | 化学反应过程中,反应物分子内的化学键断裂,产物分子中化学键形成 | |
| D. | 化学键是一种作用力 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验设计 | 实验目的 |
| A | 在热的NaOH溶液中滴入饱和FeCl3溶液 | 制备Fe(OH)3胶体 |
| B | 将SO2通入KMnO4溶液 | 验证SO2的漂白性 |
| C | 向含少量Fe3+的MgCl2溶液中加入适量MgCO3粉末,加热、搅拌并过滤 | 除去MgCl2溶液中少量的Fe3+ |
| D | 将0.1mol•L-1的Na2SO4溶液滴入BaCl2溶液至不再有沉淀产生,再滴加0.1mol•L-1的Na2CO3溶液 | 比较BaCO3与BaSO4溶度积的大小 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com