
| 序号 | 实验操作 | 实验目的 |
| A | 浓、稀HNO3分别与Cu反应 | 比较浓、稀HNO3的氧化性强弱 |
| B | 验证Ksp(AgI)<Ksp(AgCl) | 向含等物质的量NaCl、KI的混合液中滴加AgNO3溶液 |
| C | 往稀硫酸中加入少量硫酸铜 | 加快锌与稀硫酸反应的反应速率 |
| D | 检验乙酸溶液中是否混有乙醇 | 取样液于试管,加一绿豆颗粒大的钠粒 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.浓、稀硝酸的强氧化性不同,与铜反应的剧烈程度不同;
B.溶度积常数小的物质先沉淀;
C.Zn能置换出Cu,Zn、Cu和稀硫酸构成原电池;
D.Na和乙酸、乙醇都反应.
解答 解:A.浓、稀硝酸的强氧化性不同,与铜反应的剧烈程度不同,浓硝酸氧化性较强,可与铜剧烈反应,能达到实验目的,故A不选;
B.溶度积常数小的物质先沉淀,向含等物质的量NaCl、KI的混合液中滴加AgNO3溶液,先生成AgI,说明Ksp(AgI)<Ksp(AgCl),能实现实验目的,故B故选;
C.Zn能置换出Cu,Zn、Cu和稀硫酸构成原电池,从而加快反应速率,故C不选;
D.乙酸、乙醇均能与钠反应产生气体,不能检验是否含乙醇,故D选;
故选D.
点评 本题考查化学实验方案的评价,为高频考点,涉及酸浓度与氧化性强弱关系、原电池对反应速率影响、沉淀的生成等,把握物质的性质、反应原理为解答的关键,侧重分析与实验能力的考查,题目难度不大.


 名师点拨卷系列答案
名师点拨卷系列答案 英才计划期末调研系列答案
英才计划期末调研系列答案科目:高中化学 来源: 题型:选择题
| A. | MgCl2溶液 | B. | CuSO4溶液 | C. | FeCl3溶液 | D. | Al2(SO4)3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
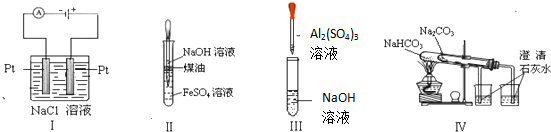
| A. | 实验Ⅰ:制取金属钠 | B. | 实验II:制取Fe(OH)2 | ||
| C. | 实验Ⅲ:制取少量的氢氧化铝 | D. | 实验Ⅳ:比较两种物质的热稳定性 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验 序号 | 初始浓度c/(mol•L-1) | 溴颜色消失 所需时间t/s | ||
| CH3COCH3 | HCl | Br2 | ||
| ① | 1.60 | 0.40 | 0.0020 | 580 |
| ② | 3.20 | 0.40 | 0.0020 | 290 |
| ③ | 1.60 | 0.80 | 0.0020 | 290 |
| ④ | 1.60 | 0.40 | 0.0040 | 1160 |
| A. | 由①④实验对比,可以得出增大c(Br2),v(Br2)减小 | |
| B. | 由②③实验对比,可以得出实验②和③的v(Br2)相等 | |
| C. | 由①③实验对比,可以得出增大c(HCl),v(Br2)增大 | |
| D. | 由①②实验对比,可以得出增大c(CH3COCH3),v(Br2)增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 选项 | 实验目的 | 主要仪器 | 试剂 |
| A | 分离Br2和CCl4的混合物 | 分液漏斗、烧杯 | Br2和CCl4的混合物、蒸馏水 |
| B | 制备Fe(OH)3胶体 | 烧杯、玻璃棒、酒精灯 | 1.0mol/L FeCl3溶液、蒸馏水 |
| C | 实验室制取NH3 | 试管、带导管的橡皮塞 | 浓氨水、生石灰 |
| D | 测定NaOH溶液浓度 | 滴定管、锥形瓶、烧杯 | NaOH溶液、0.100 0mol/L盐酸、酚酞溶液 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 已知2C(s)+O2 (g)═2CO(g)△H=-221kJ/mol,则可知C的燃烧热△H=-110.5kJ/mol | |
| B. | 稀醋酸与0.1 mol/LNaOH溶液反应:H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ/mol | |
| C. | 已知1 mol氢气完全燃烧生成液态水所放出的热量为285.5 kJ,则水分解的热化学方程式:2H2O(l)═2H2(g)+O2(g)△H=+285.5kJ/mol | |
| D. | 密闭容器中,9.6g硫粉与11.2g铁粉混合加热生成硫化亚铁17.6 g时,放出19.12 kJ热量.则Fe(s)+S(s)═FeS(s)△H=-95.6kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 化学键 | C-H | C=C | C-C | H-H |
| 键能(KJ/mol) | 615.3 | 414.4 | 347.4 | 435.3 |
| A. | 已知则可以计算CH3-CH3(g)→CH2=CH2(g)+H2(g);△H=+125.6KJ/mol | |
| B. | NH3+H3O+=NH4++H2O,说明NH3结合H+能力比H2O强 | |
| C. | 室温下,用0.100mol.L-1NaOH溶液滴定20.00mL0.100mol.L-1的醋酸,V(NaOH)=10.00mL时,$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$<1 | |
| D. | 已知中和热为-57.4KJ/mol,则NaOH(aq)+CH3COOH(aq)=CH3COONa+H2O(l)△H=-57.4KJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 强碱性溶液中:K+、Na+、Cl-、SO42- | |
| B. | 含有0.1mol•L-1Fe3+的溶液中:K+、Mg2+、SCN-、NO3- | |
| C. | 澄清透明的无色溶液:ClO-、MnO4-、Al3+、S2- | |
| D. | 室温下,pH=1的溶液中:Na+、ClO-、NO3-、SO42- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com