
| A. | 4 | B. | 3 | C. | 2 | D. | 1 |
分析 根据v=$\frac{△c}{△t}$=$\frac{\frac{△n}{V}}{△t}$计算W的平均化学反应速率,再根据同一化学反应同一时间段内,各物质的反应速率之比等于计量数之比判断n值.
解答 解:5min内W的平均化学反应速率v(W)=$\frac{\frac{△n}{V}}{△t}$=$\frac{\frac{0.2mol}{2L}}{5min}$=0.02mol/(L.min),同一化学反应同一时间段内,各物质的反应速率之比等于计量数之比,Y浓度变化表示的平均反应速率=$\frac{\frac{0.1mol}{2L}}{5min}$=0.01mol/L•min,v(Y):v(W)=0.01mol/(L•min):0.02mol/(L.min)=n:2=1:2,所以n=1,
故选D.
点评 本题主要考查了反应速率的定量表示方法,难度不大,明确同一化学反应同一时间段内,各物质的反应速率之比等于计量数之比是解本题的关键.


科目:高中化学 来源: 题型:解答题
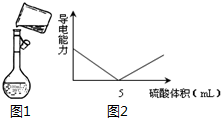 用98%的浓硫酸(密度为1.84g/mL)配制500mL 0.30mol/L 稀硫酸的实验步骤如下:①计算所用浓硫酸的体积;②量取一定体积的浓硫酸;③稀释;④冷却,转移、洗涤摇匀;⑤定容、摇匀;⑥转入试剂瓶,贴标签.
用98%的浓硫酸(密度为1.84g/mL)配制500mL 0.30mol/L 稀硫酸的实验步骤如下:①计算所用浓硫酸的体积;②量取一定体积的浓硫酸;③稀释;④冷却,转移、洗涤摇匀;⑤定容、摇匀;⑥转入试剂瓶,贴标签.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.75 mol/L | B. | 1.5 mol/L | C. | 0.25 mol/L | D. | 0.5 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
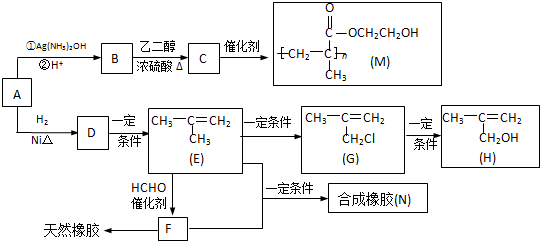
 ;
; .
.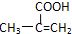 ,该不饱和酸有多种同分异构体,属于酯类且含有碳碳双键的同分异构体共有5种.
,该不饱和酸有多种同分异构体,属于酯类且含有碳碳双键的同分异构体共有5种.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 按要求完成下列小题.
按要求完成下列小题.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯分子与苯分子中碳碳键不同,但二者都能发生加成反应 | |
| B. | 乙烯、聚氯乙烯、苯乙烯分子结构中都含有不饱和键 | |
| C. | 乙醇既可以作燃料,也可以在日常生活中使用,如无水乙醇可用于杀菌、消毒、漂白 | |
| D. | 石油的分馏、裂化和煤的干馏都是化学变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
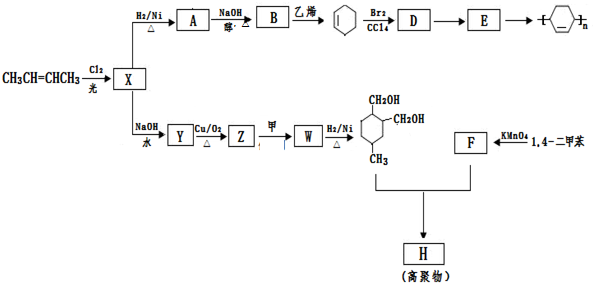
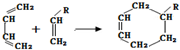 (或写成
(或写成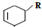 R代表取代基或氢)
R代表取代基或氢)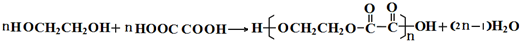
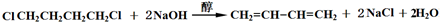 .
.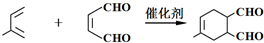 .
.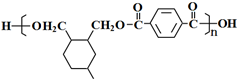 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1molBr2+2molHBr | B. | 3molHBr | C. | 4molBr2+2molH2 | D. | 2molHBr |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
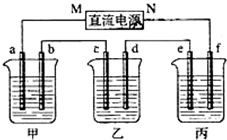 如图所示装置中,甲、乙、丙三个烧杯依次分别盛放100g 5.00%的NaOH溶液、足量的CuSO4溶液和100g 10.00%的K2SO4溶液,电极均为石墨电极.
如图所示装置中,甲、乙、丙三个烧杯依次分别盛放100g 5.00%的NaOH溶液、足量的CuSO4溶液和100g 10.00%的K2SO4溶液,电极均为石墨电极.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com