
����Ŀ��������һ�ּ��߷�չDZ���������Դ����̫����Ϊ��Դ���Ȼ�ѧ���ѭ���ֽ�ˮ��һ�ָ�Ч������Ⱦ�����ⷽ�����䷴Ӧ��������ͼ��ʾ��
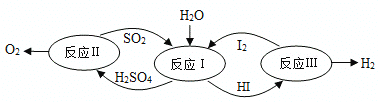
��1����Ӧ��Ļ�ѧ����ʽ��_______________________��
��Ӧ��Ļ�ѧ����ʽ��____________________��
��2��SO2���ŷ����γ������ԭ��֮һ�����ǰ�pHС��_____�����Ϊ���ꡣ
��3����Ӧ��õ��IJ�����I2���з��롣�ò������Һ�ڹ���I2�Ĵ����»�ֳ����㣬�ֱ��Ǻ���Ũ��I2��H2SO4���Ũ�ȵ�I2��HI�㡣
�ٸ���������ʵ������˵����ȷ����____________��ѡ����ţ���
a��������Һ���ܶȴ��ڲ���
b����I2ǰ��H2SO4��Һ��HI��Һ������
c��I2��HI��Һ�б���H2SO4��Һ������
�ڷ�������Һ���õ��IJ���������Ҫ��_____________________��
�۱��������Һ�ķ�����____________��
�ܾ���⣬H2SO4����c(H+)��c(SO42-)=2.06��1�����ֵ����2��ԭ����__________________________��
��4����Ӧ��2H2SO4(l)��2SO2(g)+O2(g)+2H2O(g)����֪����9 gˮ��������137.5 KJ��������д���÷�Ӧ���Ȼ�ѧ����ʽ_______________________��
���𰸡� SO2+I2+2H2O��H2SO4+2HI 2HI![]() H2+I2 5.6 ac ��Һ©�����ձ� �۲���Һ��ɫ����ɫ���ΪHI�㣬��ɫdz��Ϊ����� ������к�����I2��I2��ˮ��Ӧ����HI��HI�������H+ 2H2SO4(l)��2SO2(g)+O2(g)+2H2O(g) -550 KJ
H2+I2 5.6 ac ��Һ©�����ձ� �۲���Һ��ɫ����ɫ���ΪHI�㣬��ɫdz��Ϊ����� ������к�����I2��I2��ˮ��Ӧ����HI��HI�������H+ 2H2SO4(l)��2SO2(g)+O2(g)+2H2O(g) -550 KJ
����������Ӧ����SO2�ܽ��ڵ�ˮ�����������HI��������Ӧ�Ļ�ѧ����ʽ��SO2+I2+2H2O��H2SO4+2HI ��
��Ӧ���Dz��ȶ���HI���ȷֽ����ɵⵥ�ʺ�������������Ӧ�Ļ�ѧ����ʽ��2HI![]() H2+I2��
H2+I2��
��������ˮ�����ж�����̼���������ԣ�ͨ����pHС�� 5.6����ˮ��Ϊ���ꡣ
��a��������Һ���ܶȴ��ڲ�ų������²㣬��a��ȷ��b����I2ǰ��H2SO4��Һ��HI��Һ���ܣ���ֲ��أ���b����c��I2��HI��Һ�б���H2SO4��Һ�����ܣ�����ڲ�ͬ�ܼ����ܽ��Բ�ͬ��������ȡ����ֲ��йأ���c��ȷ���ʴ�Ϊac��
�ڷ�Һ������Ҫ����Ҫ���������з�Һ©�����ձ���
�۱��������Һ�ķ����ǹ۲���ɫ����ɫ���ΪHI�㣬��ɫdz��Ϊ����㣻
��H2SO4����c��H+����c��SO42-��=2.06��1�����ֵ����2��ԭ����������к�������I����HI����������ӡ�
9 gˮ���������ʵ���Ϊ![]() =0.5mol��������2molˮ�������յ�����Ϊ137.5 KJ��4=-550 KJ���ʸ÷�Ӧ���Ȼ�ѧ����ʽΪ2H2SO4(l)��2SO2(g)+O2(g)+2H2O(g) -550 KJ��
=0.5mol��������2molˮ�������յ�����Ϊ137.5 KJ��4=-550 KJ���ʸ÷�Ӧ���Ȼ�ѧ����ʽΪ2H2SO4(l)��2SO2(g)+O2(g)+2H2O(g) -550 KJ��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����мס�������������ˮ�Ļ������֪��ˮ��Һ�����磬�ҵ�ˮ��Һ�ܵ��磬�����й�˵����ȷ���ǣ� ��
A.��һ���ǹ��ۻ������һ�������ӻ�����
B.��һ���ǹ��ۻ�����ҿ����ǹ��ۻ�����
C.���������ӻ�����ҿ����ǹ��ۻ�����
D.��һ�������ӻ�����ҿ����ǹ��ۻ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��I.��FeCl3��KSCN��Һ�д�������ƽ�⣺ Fe3+(��ɫ)+3SCN-(��ɫ)![]() Fe(SCN)3(��ɫ)����������Һ����������֧�Թ��У�������һ֧�Թ��м��뱥��FeCl3��Һ����Һ��ɫ��_________������dz������ͬ����ƽ����___________����������桱����ͬ�������ƶ�������һ֧�Թ��еμ� 0.01mol/LNaOH ��Һ����Һ��ɫ��__________��ƽ����___________�����ƶ���
Fe(SCN)3(��ɫ)����������Һ����������֧�Թ��У�������һ֧�Թ��м��뱥��FeCl3��Һ����Һ��ɫ��_________������dz������ͬ����ƽ����___________����������桱����ͬ�������ƶ�������һ֧�Թ��еμ� 0.01mol/LNaOH ��Һ����Һ��ɫ��__________��ƽ����___________�����ƶ���
������֧�ݻ���Ϊ30cm3��Ͳ�зֱ����10cm3NO2 ���壬����Ͳǰ�˷�գ�����2NO2������ɫ��N2O4����ɫ��ƽ����ϵ�����ڶ�֧��Ͳ����Ѹ������5cm3 ������ʱ�������ɫ���һ��ʱ���������ɫ�ֱ�dz�ˣ����Աȵ�һ֧��Ͳ�������ɫ�
���ƽ���Ͳ����ɫ���һ��ʱ����ֱ�dz��ԭ����______________��
�ڵڶ�֧��Ͳ���ձȵ�һ֧��Ͳ������ɫ���ԭ����_____________��
��. ���� a.HCl b.H2SO4 c.CH3COOH
����������Һ�����ʵ���Ũ����ͬ���� C(H+)�Ӵ�С����Ϊ____________��������ĸ��ű�ʾ����ͬ��
����������Һ�ĵ� C(H+)��ͬ��ȡ���������������Һ���ֱ��õ�Ũ�ȵ�NaOH ��Һ��ȫ�кͣ����� NaOH ��Һ�����С��ϵΪ_____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и������ʵ�ȼ������ȵ���
A. C��CO B. ���Ͱ���
C. 3molC2H2����Ȳ����1molC6H6������ D. 1gH2��2gH2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���״�����Ҫ�Ļ�ѧ��ҵ����ԭ�Ϻ����Һ��ȼ�ϡ���ҵ�Ͽ�����CO��CO2������ȼ�ϼ״�����֪�״��Ʊ����йػ�ѧ��Ӧ�Լ��ڲ�ͬ�¶��µĻ�ѧ��Ӧƽ�ⳣ�����±���ʾ��
��ѧ��Ӧ | ƽ�� ���� | �¶�/�� | |
500 | 800 | ||
��2H2��g����CO��g�� | K1 | 2.5 | 0.15 |
��H2��g����CO2��g�� | K2 | 1.0 | 2.50 |
��3H2��g����CO2��g�� | K3 | ||
��1�� �ݷ�Ӧ����ڿ��Ƶ���K1��K2��K3֮��Ĺ�ϵ����K3��________����K1��K2��ʾ����500 ��ʱ��÷�Ӧ����ijʱ�̣�H2��g����CO2��g����CH3OH��g����H2O��g����Ũ����mol��L��1���ֱ�Ϊ0.8��0.1��0.3��0.15�����ʱv��__________v�����>������������<������
��2�� ���ڷ�Ӧ�ۣ�����ͬ�¶Ⱥ��ݻ�����ʱ����˵���÷�Ӧ�Ѵ�ƽ��״̬����
A��n��CO2����n��H2����n��CH3OH����n��H2O����1��3��1��1
B��������ѹǿ���ֲ���
C��H2������������CH3OH����������֮��Ϊ3��1
D�������ڵ��ܶȱ��ֲ���
�����ٷɻ���ƽ�������ʱ��β���е�NO���ƻ������㡣��ѧ�������о����ô�������β���е�NO��COת���CO2��N2,��ѧ����ʽ���£�2NO��g��+2CO��g��![]() 2CO2��g��+N2��g����H<0
2CO2��g��+N2��g����H<0
Ϊ�˲ⶨ��ij�ִ��������µķ�Ӧ���ʣ���ij�¶��������崫������ò�ͬʱ���NO��COŨ�������
ʱ����s�� | 0 | 1 | 2 | 3 | 4 | 5 |
c��NO����mol/L�� | 1.00��10��3 | 4.50��10�� 4 | 2.50��10�� 4 | 1.50��10�� 4 | 1.00��10�� 4 | 1.00��10�� 4 |
c��CO����mol/L�� | 3.60��10�� 3 | 3.05��10�� 3 | 2.85��10�� 3 | 2.75��10�� 3 | 2.70��10�� 3 | 2.70��10�� 3 |
��ش��������������������¶ȱ仯�Դ�����Ч�ʵ�Ӱ������
��1��ǰ2s�ڵ�ƽ����Ӧ��������N2���� ��CO��ƽ��ת����Ϊ____________���������������λ��Ч������
��2��д���÷�Ӧ��ƽ�ⳣ��K�ı���ʽ________________��
��3���������ܱ������з���������Ӧ���ﵽƽ��ʱ���д�ʩ�����NOת���ʵ��� ��
A��ѡ�ø���Ч�Ĵ��� B�����߷�Ӧ��ϵ���¶�
C�����ͷ�Ӧ��ϵ���¶� D����С���������
��4���о���������ʹ�õ���������ʱ����������ȱ���������ѧ��Ӧ���ʡ�ijͬѧ���������ʵ�飬ʵ�������Ѿ���������ʵ����Ʊ��С�
ʵ�� ��� | T������ | NO��ʼŨ�� ��mol/L�� | CO��ʼŨ�� ��mol/L�� | �����ıȱ������m2/g�� |
�� | 280 | 1.20��10��3 | 5.80��10��3 | 82 |
�� | 280 | 1.20��10��3 | 5.80��10��3 | 124 |
�� | 350 | 1.20��10��3 | 5.80��10��3 | 124 |
����������ʵ���ʵ��Ŀ����_______________________��
�����ڸ���������ͼ�У������ϱ��еĵ�����ʵ�������»��������NOŨ����ʱ��仯����������ͼ��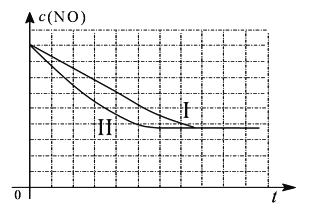
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1����12.7g ��̬����������ȫ��Ӧ���ɵ⻯������ʱ������2.604kJ���������÷�Ӧ���Ȼ�ѧ����ʽΪ____________________��
��2���� NA��ʾ�����ӵ��������� C2H2����̬����ȫȼ������ CO2��Һ̬ˮ�ķ�Ӧ�У�ÿ��5NA������ת��ʱ���ų� 650kJ �����������ʾ C2H2����̬�� ȼ���ȵ��Ȼ�ѧ����ʽΪ____________��
��3����������ʱ��������Ϊȼ�ϣ�NO2��������������
��֪�� N2(g)��2O2(g)=2NO2 (g) ��H����68kJ��mol��1
N2H4(g)��O2(g)=N2(g)��2H2O(g) ��H����534kJ��mol��1
д����̬�º�NO2��Ӧ���ɵ�����ˮ�������Ȼ�ѧ����ʽ___________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ӷ�Ӧ������л���ӵİٷ������ǣ� ��
A.�����¶�
B.ʹ�ô���
C.����ѹǿ
D.����Ũ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������仯ʾ��ͼ������˵����ȷ����

A. C(���ʯ��s)+O2=CO2(g) ��H=(E4-E1)kJ/mol
B. 2C(ʯī��s)+O2(g)=2CO(g) ��H=(E2-E3)kJ/mol
C. C(ʯī��s)=C(���ʯ,s) ��H=(E3-E4)kJ/mol
D. 2CO2(g)=2CO(g)+O2(g) ��H=2(E2-E1)kJ/mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ϊ������NH![]() ��Ũ����Cl����Ũ�ȱ�Ϊ1��1����Һ������NH4Cl��Һ�м���
��Ũ����Cl����Ũ�ȱ�Ϊ1��1����Һ������NH4Cl��Һ�м���
������������ ��������NaCl �������İ�ˮ��������NaOH
A���٢� B���� C���ۢ� D����
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com