
【题目】某温度下,在一个2 L的密闭容器中,加入4 mol A 和 2 mol B 进行如下反应:3A(g)+2B(g)![]() 4C(s)+2D(g),反应一段时间后达到平衡,测得生成 1.6 mol C, 下列说法正确的是( )
4C(s)+2D(g),反应一段时间后达到平衡,测得生成 1.6 mol C, 下列说法正确的是( )
A. 该反应的化学平衡常数表达式是K=![]()
B. 此时,B 的平衡转化率是40%
C. 增大该体系的压强,化学平衡常数增大
D. 增加 B,B 的平衡转化率增大
科目:高中化学 来源: 题型:
【题目】下列有关物质的性质和该性质的应用均正确的是( )
A.SiO2是酸性氧化物,可制成玻璃容器盛装氢氟酸
B.氧化铁为红棕色固体,可用于作油漆红色涂料
C.次氯酸有酸性,可用于自来水的杀菌消毒
D.钠具有金属活泼性,钠可以从硫酸铜溶液中置换出金属铜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列陈述正确并且有因果关系的是
选项 | 陈述Ⅰ | 陈述Ⅱ |
A | SO2有漂白性 | SO2可使溴水褪色 |
B | SiO2有导电性 | SiO2可用于制备光导纤维 |
C | 浓硫酸有强氧化性 | 浓硫酸可用于干燥H2和CO |
D | Fe3+有强氧化性 | FeCl3溶液可用于回收废旧电路板中的铜 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】砷的一些化合物常用作半导体、除草剂、杀鼠药等。回答下列问题:
(1)基态As原子的核外电子排布式为[Ar]__________,有___________个未成对电子。
(2)镓氮砷合金材料的太阳能电池效率达40%。Ga、N、As电负性由大至小的顺序是_____________。
(3)As4O6的分子结构如图所示,其中As原子的杂化方式为____________,1mol 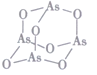 As4O6含有σ键的物质的量为________mol。
As4O6含有σ键的物质的量为________mol。
(4)晶胞有两个基本要素:
①原子坐标参数,表示晶胞内部各原子的相对位置,LiZnAs基稀磁半导体的晶胞如图所示,其中原子
坐标参数A处Li为(0,0, ![]() );B处As为(
);B处As为(![]() ,
, ![]() ,
, ![]() );C处Li的坐标参数为_____________。
);C处Li的坐标参数为_____________。
②晶胞参数,描述晶胞的大小和形状,已知LiZnAs单晶的晶胞参数α=594 pm,NA表示阿伏加德罗常数的数值,其密度为____________g·cm-3(列出计算式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用KMnO4氧化溶质质量分数为36.5%的盐酸。反应方程式如下:
2KMnO4+16HCl═2KCl+2MnCl2+5Cl2↑+8H2O
(1)若此盐酸的密度为1.2g/cm3,其物质的量浓度为_________________________;
(2)用双线桥表示电子的得失_________________________;
(3)此反应中氧化剂是_________,氧化产物____________;
(4)若有xmolKMnO4参加反应,则转移电子的物质的量为____________;
(5)15.8gKMnO4完全反应,产生标准状况下Cl2的体积为_________,同时有_______molHCl被氧化。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(8分)现有甲、乙、丙三名同学分别进行Fe(OH)3胶体的制备实验。
甲同学:向1 mol·L-1的FeCl3溶液中加少量NaOH溶液。
乙同学:直接加热饱和FeCl3溶液。
丙同学:向25 mL沸水中逐滴加入5~6滴FeCl3饱和溶液;继续煮沸至溶液呈红褐色,停止加热。
试回答下列问题:
⑴其中操作正确的同学是___ _____。
⑵证明有Fe(OH)3胶体生成利用的胶体性质是______ __。
⑶在胶体中加入电解质溶液或带有相反电荷的胶体微粒能使胶体微粒沉淀出来。丁同学利用所制得的Fe(OH)3胶体进行实验:
① 将其装入U形管内,用石墨作电极,通电一段时间后发现与电源负极相连的电极区附近的颜色逐渐变深,这表明Fe(OH)3胶体微粒带__________(填“正”或“负”)电荷。
② 若向其中加入饱和Na2SO4溶液,产生的现象是 。
③若向其中加入浓盐酸溶液,产生的现象是 。
(4)Fe(OH)3胶体制备的化学方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种将燃料电池与电解池组合制备KMnO4的装置如图所示(电极甲、乙、丙、丁均为惰性电极)。该装置工作时,下列说法不正确的是( )
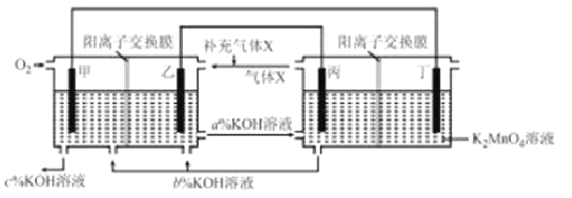
A. 电极丁的反应式为MnO42--e-= MnO4-
B. 电极乙附近溶液的pH减小
C. KOH溶液的质量分数:c%>a%>b%
D. 导线中流过2 mol电子时,理论上有2mol K+ 移入阴极区
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯酸镁[Mg(ClO3)2]常用作催熟剂、除草剂等,实验室制备少量Mg(ClO3)2·6H2O的流程如下:
已知:①卤块主要成分为MgCl2·6H2O,含有MgSO4、FeCl2等杂质。
②四种化合物的溶解度(S)随温度(T)变化曲线如图所示。

(1)过滤所需要的主要玻璃仪器有________________________________。
(2)加入BaCl2的目的是_______________,加MgO后过滤所得滤渣的主要成分为___。
(3)加入NaClO3饱和溶液后发生反应的化学方程式为__________________________,
再进一步制取Mg(ClO3)2·6H2O的实验步骤依次为:
①蒸发结晶;②___________;洗涤;③将滤液冷却结晶;④过滤、洗涤。
(4)产品中Mg(ClO3)2·6H2O含量的测定(已知Mg(ClO3)2·6H2O的摩尔质量为299g/mol )。
步骤1:准确称量3.50 g产品配成100 mL溶液。
步骤2:取10.00mL于锥形瓶中,加入10.00mL稀硫酸和20.00mL1.000 mol·L-1的FeSO4溶液,微热。
步骤3:冷却至室温,用0.100 mol/L K2Cr2O7溶液滴定剩余的Fe2+至终点。反应的方程式为:
______Cr2O72-+___Fe2++___ H+= ___Cr3++___Fe3++____H2O (请配平)。
步骤4:将步骤2、3重复两次,平均消耗K2Cr2O7溶液15.00 mL。
写出步骤2中发生反应的离子方程式________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com