
【题目】用KMnO4氧化溶质质量分数为36.5%的盐酸。反应方程式如下:
2KMnO4+16HCl═2KCl+2MnCl2+5Cl2↑+8H2O
(1)若此盐酸的密度为1.2g/cm3,其物质的量浓度为_________________________;
(2)用双线桥表示电子的得失_________________________;
(3)此反应中氧化剂是_________,氧化产物____________;
(4)若有xmolKMnO4参加反应,则转移电子的物质的量为____________;
(5)15.8gKMnO4完全反应,产生标准状况下Cl2的体积为_________,同时有_______molHCl被氧化。
【答案】 12mol/L 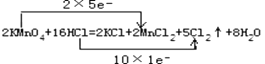 KMnO4 Cl2 5xmol 5.6L 0.5
KMnO4 Cl2 5xmol 5.6L 0.5
【解析】(1)盐酸的物质的量浓度=![]() =
=![]() mol/L=12mol/L,故答案为:12mol/L;
mol/L=12mol/L,故答案为:12mol/L;
(2)反应中高锰酸钾为氧化剂,浓盐酸为还原剂,Mn元素的化合价+7→+2,和Cl元素的化合价-1→0,反应中氧化剂和还原剂得失电子数目相等,故答案为: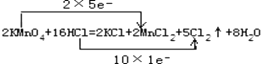 ;
;
(3)反应中锰元素化合价降低,锰元素所在的反应物KMnO4是氧化剂,氯化氢是还原剂,对应的产物是氧化产物,故答案为:KMnO4,Cl2;
(4)该反应中Mn元素化合价由+7价变为+2价,所以转移电子的物质的量=xmol×(7-2)=5xmol,故答案为:5xmol;
(5)高锰酸钾的量、氯气的量以及消耗的盐酸之间的关系为:2KMnO4~5Cl2~16HCl,被氧化的盐酸和参加反应的盐酸的量之比为:![]() ,15.8gKMnO4 的物质的量为0.1mol,完全反应时,产生的Cl2为0.25mol,在标准状况下的体积为0.25mol×22.4L/mol=5.6L,消耗的HCl为0.8mol,被氧化的HCl为0.5mol,故答案为:5.6L;0.5。
,15.8gKMnO4 的物质的量为0.1mol,完全反应时,产生的Cl2为0.25mol,在标准状况下的体积为0.25mol×22.4L/mol=5.6L,消耗的HCl为0.8mol,被氧化的HCl为0.5mol,故答案为:5.6L;0.5。


 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案 初中学业考试导与练系列答案
初中学业考试导与练系列答案科目:高中化学 来源: 题型:
【题目】某温度下,将Cl2通入NaOH溶液中,反应得到NaCl、NaClO、NaClO3的混合液,经测定被还原的氯元素与被氧化的氯元素的物质的量之比为3∶1,则Cl2与NaOH溶液反应时,所得溶液中Cl-与ClO![]() 的物质的量浓度之比为( )
的物质的量浓度之比为( )
A. 21∶5 B. 1∶1 C. 6∶1 D. 4∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ、掌握仪器的名称、组装及使用方法是中学化学实验的基础,观察下图实验装置。

(1)写出图中玻璃仪器的名称:①______________,②______________。
(2)若利用该装置分离四氯化碳和酒精的混合物,还缺少的仪器有___________,将仪器补充完整后进行的实验操作的名称为____________;冷凝管的进水口是________(填“f”或“g”)。
Ⅱ、柠檬酸亚铁(FeC6H6O7)是一种易吸收的高效铁制剂,可由绿矾(FeSO47H2O)通过下列反应制备:
FeSO4+Na2CO3 === FeCO3↓+Na2SO4
FeCO3+C6H8O7 === FeC6H6O7+CO2↑+H2O
(1)生成的FeCO3沉淀需经充分洗涤,检验洗涤是否完全的 方法是 ________________________。
(2)结合如图绿矾溶解度曲线,要从FeSO4溶液中得到FeSO47H2O晶体,先通过 __________得到_____℃饱和溶液,再冷却至_____℃ 结晶,过滤,少量冰水洗涤,低温干燥。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质分类正确的是
A.SO2、SiO2、CO均为酸性氧化物
B.稀豆浆、硅酸、氯化铁溶液均为胶体
C.烧碱、冰醋酸、四氯化碳均为电解质
D.福尔马林、水玻璃、氨水均为混合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性小组借助下列装置,验证Ag与浓硝酸反应的过程中可能产生NO。据此回答下列问题:

(1)仪器M的名称为_________。
(2)用上图所示装置,组合一套用水吸收生成的NO2并测定生成NO体积的装置,其合理的连接顺序
是____________(填各导管的序号)。反应前,先通入N2的目的是____________。
(3)从装置C中取25.00 mL实验后的溶液(忽略溶液体积变化)于锥形瓶中,并滴加23滴酚酞作指示剂,用0.10 mol·L-1的NaOH标准液进行滴定,终点时,消耗NaOH溶液20.00mL。滴定达到终点的标志是________________。
(4)若实验测得NO的体积为112.0 mL(标准状况),则Ag与浓硝酸反应的过程中____________(填“有”或“没有”)NO产生,原因是_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,在一个2 L的密闭容器中,加入4 mol A 和 2 mol B 进行如下反应:3A(g)+2B(g)![]() 4C(s)+2D(g),反应一段时间后达到平衡,测得生成 1.6 mol C, 下列说法正确的是( )
4C(s)+2D(g),反应一段时间后达到平衡,测得生成 1.6 mol C, 下列说法正确的是( )
A. 该反应的化学平衡常数表达式是K=![]()
B. 此时,B 的平衡转化率是40%
C. 增大该体系的压强,化学平衡常数增大
D. 增加 B,B 的平衡转化率增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
从樟科植物枝叶提取的精油中含有下列甲、乙、丙三种成分:

(1)甲中含氧官能团的名称为________。
(2)由甲转化为乙需经下列过程(已略去各步反应的无关产物,下同):

其中反应Ⅰ的反应类型为________,反应Ⅱ的化学方程式为____________________(注明反应条件)。
(3)已知:![]()
![]()
由乙制丙的一种合成路线图如下(A~F均为有机物,图中 Mr 表示相对分子质量):

(4)①下列物质不能与C反应的是________(选填序号)。
a.金属钠 b.HBr c.Na2CO3溶液 d.乙酸
②写出F的结构简式_______________________________。
③能同时满足下列条件的D 异构体有_______种同分异构体,任写其中一种能同时满足下列条件的异构体结构简式_________。
a.能发生银镜反应.
b.能与 Br2/CCl4 发生加成反应
c.遇 FeCl3 溶液显示特征颜色
④综上分析,丙的结构简式为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】( N2H4)又称联氨,广泛用于火箭推进剂、有机合成及燃料电池, NO2 的二聚体 N2O4 则是火箭中常用氧化剂。试回答下列问题
(1)肼的结构式为____________。
(2)肼燃料电池原理如图所示,左边电极上发生的电极反应式为_________________。

(3)火箭常用 N2O4 作氧化剂,肼作燃料,已知:
N2(g)+2O2(g)=2NO2(g) △H=-67.7kJ·mol-1
N2H4(g)+O2(g)=N2(g)+2H2O(g) △H=-534.0kJ·mol-1
2NO2(g) ![]() N2O4(g) △H=-52.7kJ·mol-1
N2O4(g) △H=-52.7kJ·mol-1
写出气态肼在气态四氧化二氮中燃烧生成氮气和气态水的热化学方程式:_________________。
(4)联氨的工业生产常用氨和次氯酸钠为原料获得,也可在催化剂作用下,用尿素[CO(NH2)2]和次氯酸钠与氢氧化钠的混合溶液反应获得,尿素法反应的离子方程式为_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近年来有多个品牌的手机电池曾发生爆炸事故,公众对电池安全性的重视程度越来越高,燃料电池作为安全性能较好的一类化学电源得到了更快的发展。 一种以联氨(N2H4)为燃料的环保电池工作原理如图所示,工作时产生稳定无污染的物质。下列说法不正确的是( )

A. M极生成氮气且电极附近pH降低
B. 负极上每消耗1molN2H4,会有4molH+通过质子交换膜
C. 正极的电极反应式为:O2+4H++4e-=2H2O
D. d口流出的液体是蒸馏水
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com