
【题目】下列微粒中同时具有离子键、共价键和配位键的化合物是
A.NH4Cl B.Na2O2 C.H3O+ D.MgO
 名校通行证有效作业系列答案
名校通行证有效作业系列答案科目:高中化学 来源: 题型:
【题目】【2015新课标2】某羧酸酯的分子式为C18H26O5,1mol该酯完全水解可得到1mol羧酸和2mol乙醇,该羧酸的分子式为( )
A.C14H18O5 B.C14H16O4 C.C14H22O5 D.C14H10O5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用下列实验装置完成相应的实验,能达到实验目的的是( )

A.称量NaOH固体 B.用酒精提取溴水中的溴 C.除去水中的氯化钠 D.从Y进气收集CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乳酸亚铁([CH3CH(OH)COO]2Fe.3H2O,Mr=288)是一种常用的补铁剂,可通过是一种常用的补铁剂,可通过乳酸与碳酸亚铁反应制得:CH3CH(OH)COOH+FeCO3+2H2O→[CH3CH(OH)COO]2Fe·3H2O+CO2↑。
已知FeCO3易被氧化:4FeCO3+6H2O+O2=4Fe(OH)3+4CO2。
某兴趣小组用FeCl2(用铁粉和稀盐酸制得)和NH4HCO3制备FeCO3的装置示意图如下:
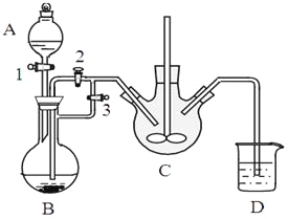
回答下列问题:
(1)NH4HCO3盛放在装置 中(填字母),该装置中涉及的主要反应的离子方程式____________。
(2)将生成的FeCl2溶液和NH4HCO3溶液混合时的操作是_________________。
(3)将制得的FeCO3加入到足量乳酸溶液中,再加入少量铁粉,75℃下搅拌反应。铁粉的作用是________,
反应结束后,无需过滤,除去过量铁粉的方法是 。
(4)该兴趣小组用KMnO4法测定样品中亚铁含量进而计算产品中乳酸亚铁的质量分数,高锰酸钾标准液用_________滴定管盛装(填“酸式”或“碱式”)。下列操作会引起测定结果偏高的是_________。
A.滴定管在盛装高锰酸钾前未润洗
B.滴定过程中,锥形瓶震荡的太剧烈,以致部分液体溅出
C.滴定前读数正确,滴定终点时俯视读数
D.滴定前读数正确,滴定终点时仰视读数
(5)经查阅文献后,该兴趣小组改用铈(Ce)量法测定产品中Fe2+的含量。取2.880g产品配成100mL溶液,每次取20.00mL,进行必要处理,用0.1000mol·L-1Ce(SO4)2标准溶液滴定至终点,平均消耗Ce(SO4)2 19.70mL。滴定反应如下:Ce4++Fe2+=Ce3++Fe3+,则产品中乳酸亚铁的质量分数为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(化学---选修3:物质结构和性质)锂—磷酸氧铜电池正极的的活性物质是Cu4O(PO4)2,可通过下列反应制备:2Na3PO4+4CuSO4+2NH3·H2O=Cu4O(PO4)2↓+3Na2SO4+(NH4)2SO4+H2O
(1)写出基态Cu2+的核外电子排布式:____________,与Cu同周期的元素中,与铜原子最外层电子数相等的元素还有___________(填元素符号),上述方程式中涉及到的N、O元素第一电离能由小到大的顺序为________________。
(2)PO43-的空间构型是___________。
(3)与NH3具有相同空间构型和键合形成的分子或离子有_________、___________(各举一例)
(4)氨基乙酸铜的分子结构如图,氮原子的杂化方式为______________。

(5)在硫酸铜溶液中加入过量KCN,生成配合物[Cu(CN)4]2-,则1molCN-中含有的π键的数目为___________。
(6)Cu元素与H元素可形成一种红色化合物,其晶体结构单元如图所示。则该化合物的化学式
为______________________。
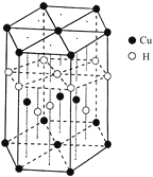
(7)铜晶体为面心立方最密堆积,铜的原子半径为127.8pm,列出晶体铜的密度表达式____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于硅的化学性质的叙述,正确的是( )
A.常温时不和任何酸反应 B.常温时可和强碱溶液反应
C.单质硅比碳的还原性强 D.单质硅比碳的氧化性强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据价层电子对互斥理论及原子的杂化理论判断NF3分子的空间构型和中心原子的杂化方式为
A.直线形 sp杂化 B.三角形 sp2杂化
C.三角锥形 sp2杂化 D.三角锥形 sp3杂化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将1 mol H2(g)和2 mol I2(g)置于某2 L密闭容器中,在一定温度下发生反应:H2(g)+I2(g)![]() 2HI(g)ΔH<0,并达到平衡,HI的体积分数w(HI)随时间(t)变化如图(Ⅱ)所 示。若改变反应条件,w(HI)的变化曲线如图(Ⅰ)所示,则改变的条件可能是
2HI(g)ΔH<0,并达到平衡,HI的体积分数w(HI)随时间(t)变化如图(Ⅱ)所 示。若改变反应条件,w(HI)的变化曲线如图(Ⅰ)所示,则改变的条件可能是

A. 恒温恒容条件下,加入适当催化剂
B. 恒温条件下,缩小反应容器体积
C. 恒容条件下,升高温度
D. 恒温条件下,扩大反应容器体积
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2A+B ![]() 3C+4D反应中,表示该反应速率最快的是 ( )
3C+4D反应中,表示该反应速率最快的是 ( )
A.v(A)=0.5 mol·L-1·s-1 B.v(B)=0.3 mol·L-1·s-1
C.v(C)=0.8 mol·L-1·s-1 D.v(D)=1 mol·L-1·s-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com