
| A、淀粉溶液中:K+、NH4+、SO42-、I2 |
| B、浓氨水中:Na+、K+、Cl-、CO32- |
| C、能使淀粉碘化钾试纸显蓝色的溶液:K+、SO42-、CO32-、SO32- |
| D、葡萄糖溶液中:Na+、H+、SO42-、Cr2O72-- |
科目:高中化学 来源: 题型:
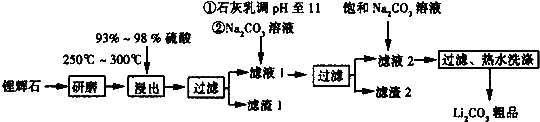
| T/℃ | 20 | 40 | 60 | 80 |
| S(Li2CO3)/g | 1.33 | 1.17 | 1.01 | 0.85 |
| S(Li2SO4)/g | 34.2 | 32.8 | 31.9 | 30.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 | 2 | 3 | |
| 0.25克样品消耗硫酸铈标准溶液的体积(ml) | 24.35 | 24.05 | 23.95 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 某钠盐W中加入稀硫酸,产生的无色无味的气体通入澄清石灰水 | 石灰水变浑浊 | W可能是Na2CO3 |
| B | 蘸有浓氨水的玻璃棒靠近溶液X | 有白烟产生 | X一定是浓盐酸 |
| C | 强酸性溶液Y中加入Ba(NO3)2溶液,静置后再加入KSCN溶液 | 先有白色沉淀, 后溶液又变红 | Y中一定含有SO42-和Fe3+ |
| D | 少量气态炔烃Z通入pH=a的溴水中 | 溴水褪色,溶液的pH仍约为a | Z与溴发生了取代反应 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 实验操作 | 现象 | 结论 |
| A | 向某溶液中滴加盐酸酸化的氯化钡溶液 | 出现白色沉淀 | 该溶液中一定存在SO42 |
| B | 向苏打和小苏打溶液中分别加入盐酸 | 均冒气泡 | -两者均能与盐酸反应 |
| C | 将可调高度的铜丝伸入到稀HNO3中 | 溶液变蓝 | Cu与稀HNO3发生置换反应 |
| D | 将KI和FeCl3溶液在试管中混合后,加入CCl4,振荡,静置 | 上层溶液 显紫红色 | 氧化性:Fe3+>I2 |
| A、A | B、B | C、C | D、D、 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、酸式滴定管在装酸液前未用标准酸液润洗 |
| B、开始时酸式滴定管尖嘴部分留有气泡,滴定过程中消失 |
| C、锥形瓶内溶液颜色由黄变橙时立即停止滴定 |
| D、盛NaOH溶液的锥形瓶滴定前用NaOH溶液润洗2~3次 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、溶解→加适量BaCl2溶液→过滤 |
| B、溶解→加适量CaCl2溶液→过滤 |
| C、溶解→加适量Ca(OH)2溶液→过滤 |
| D、溶解→加适量盐酸→加热 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com