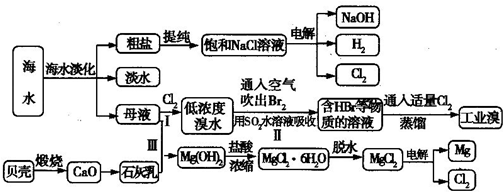
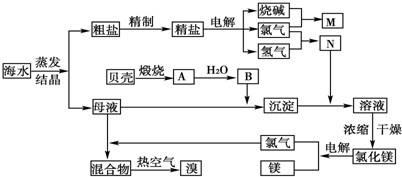
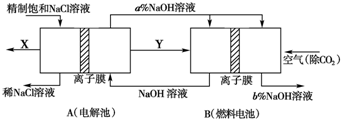
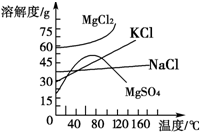
(1)在MgCl2、NaCl、Na2SO4三种盐的混合溶液1L,若Na+为3mol、Cl-为3.8mol、Mg2+为1.5mol,则Na2SO4的物质的量浓度为______mol/L.
(2)在标准状况下,100ml某气体X的质量是0.179克,则这种气体X的相对分子质量是______.
(3)铁钉在氯气中被锈蚀为棕黄色物质FeCl3,而在盐酸中生成浅绿色的FeCl2溶液.则在 Cl2、Cl-、H+中,氧化性最强的是______.
(4)有X、Y、Z三种元素,已知:①X、Y、Z的单质在常温下均为气体;②每2个X2分子可与1个Y2分子化合生成2个X2Y分子,X2Y在常温下为液体;③Z单质溶于X2Y中,所得溶液具有漂白作用;④Z单质可以与石灰乳反应制漂白粉.
①写出元素Z的名称:______.②写出④的化学反应方程式为:______.
解:(1)根据电荷守恒n(Na
+)+2n(Mg
2+)=n(Cl
-)+2n(SO
42-),即3mol+1.5mol×2=3.8mol+2n(SO
42-),解得n(SO
42-)=1.1mol,由硫酸根守恒可知n(Na
2SO
4)=n(SO
42-)=1.1mol,故Na
2SO
4的物质的量浓度为
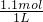
=1.1mol/L,故答案为:1.1;
(2)标准状况下,100ml某气体X的物质的量为
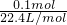
=
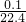
mol,其质量是0.179克,故X的摩尔质量为
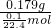
=40g/mol,故相对分子质量为40,故答案为:40;
(3)铁钉在氯气中被锈蚀为棕黄色物质FeCl
3,而在盐酸中生成浅绿色的FeCl
2溶液,同一还原剂与不同氧化剂反应,生成物的价态越高,氧化剂的氧化性越强,故氧化性Cl
2>H
+中,Cl
-处于最低价态,没有氧化性,故氧化性最强的为,故答案为:Cl
2;
(4)X、Y、Z三种元素,X、Y、Z的单质在常温下均为气体;Z单质可以与石灰乳反应制漂白粉,Z为Cl元素,X
2Y在常温下为液体,Z单质溶于X
2Y中,所得溶液具有漂白作用,X
2Y为H
2O,故X为H元素,Y为O元素,验证符合,
①由上述分析可知,元素Z的名称为氯,故答案为:氯;
②氯气与氢氧化钙反应生成氯化钙、次氯酸根与水,反应方程式为:2Cl
2+2Ca(OH)
2=CaCl
2+Ca(ClO)
2+2H
2O,故答案为:2Cl
2+2Ca(OH)
2=CaCl
2+Ca(ClO)
2+2H
2O.
分析:(1)根据电荷守恒n(Na
+)+2n(Mg
2+)=n(Cl
-)+2n(SO
42-),据此计算溶液中n(SO
42-),由硫酸根守恒可知n(Na
2SO
4)=n(SO
42-),再根据c=

计算Na
2SO
4的物质的量浓度;
(2)根据n=

计算气体的物质的量,再根据M=

计算该气体的摩尔质量,据此确定其相对分子质量;
(3)同一还原剂与不同氧化剂反应,生成物的价态越高,氧化剂的氧化性越强,Cl
-处于最低价态,没有氧化性;
(4)X、Y、Z三种元素,X、Y、Z的单质在常温下均为气体;Z单质可以与石灰乳反应制漂白粉,Z为Cl元素,X
2Y在常温下为液体,Z单质溶于X
2Y中,所得溶液具有漂白作用,X
2Y为H
2O,故X为H元素,Y为O元素,据此解答.
点评:本题属于拼凑题型,涉及混合电解质溶液中物质的量浓度计算、氧化性强弱比较、相对分子质量的计算、元素推断等,难度中等,注意(1)中利用电荷守恒计算.

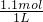 =1.1mol/L,故答案为:1.1;
=1.1mol/L,故答案为:1.1;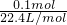 =
=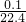 mol,其质量是0.179克,故X的摩尔质量为
mol,其质量是0.179克,故X的摩尔质量为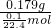 =40g/mol,故相对分子质量为40,故答案为:40;
=40g/mol,故相对分子质量为40,故答案为:40; 计算Na2SO4的物质的量浓度;
计算Na2SO4的物质的量浓度; 计算气体的物质的量,再根据M=
计算气体的物质的量,再根据M= 计算该气体的摩尔质量,据此确定其相对分子质量;
计算该气体的摩尔质量,据此确定其相对分子质量;

 优生乐园系列答案
优生乐园系列答案 新编小学单元自测题系列答案
新编小学单元自测题系列答案