
【题目】在一密闭容器中,反应mA(g)+nB(g)![]() pC(g)达到平衡时,测得c(A)为0.5 mol·L-1;在温度不变的条件下,将容器体积扩大一倍,当达到平衡时,测得c(A)为0.3 mol·L-1。则下列判断正确的是( )
pC(g)达到平衡时,测得c(A)为0.5 mol·L-1;在温度不变的条件下,将容器体积扩大一倍,当达到平衡时,测得c(A)为0.3 mol·L-1。则下列判断正确的是( )
A.化学计量数:m+n<pB.平衡向正反应方向移动了
C.物质B的转化率减小了D.物质C的质量分数增加了
科目:高中化学 来源: 题型:
【题目】化学肥料在农业生产中有重要作用。农业生产中,大量施用的化肥主要是氮肥、磷肥、钾肥。
(1)普钙是磷肥,它的有效成分是________(写化学式)。
(2)尿素是一种含氮量较高的氮肥,工业生产尿素是将氨气与二氧化碳在加压、加热的条件下反应生成氨基甲酸铵(H2NCOONH4),再使氨基甲酸铵脱水得到尿素。反应的化学方程式为______________、______________。
(3)农谚说的“粪和肥,肥料飞”指的是粪尿与草木灰搅和在一起会降低肥效。请你说明其中的化学原理:________________________。
(4)合成氨是生产氮肥的重要环节。合成氨生产简易流程示意图如下:

从示意图可知其存在循环操作。简要说明为什么在化工生产中经常采用循环操作?______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机高分子化合物H是制备药物的重要中间体,其一种合成方法如下:
已知:
①![]() ②
②![]()
③R1CHO+R2CH2CHO![]() R1CH=CR2CHO+H2O
R1CH=CR2CHO+H2O
(1)A的化学名称为______。
(2)B中含有的官能团名称为______。
(3)C的某种同分异构体,其核磁共振氢谱显示5组峰,且遇FeCl3溶液显紫色,该同分异构的结构简式为______。
(4)D的结构简式为______。
(5)由E生成F的化学方程式为______,反应类型为______。
(6)E有多种同分异构体,其中同时满足以下要求的有______种。
①与E具有相同的官能团;②属于芳香族化合物,且苯环上有三个取代基。
(7)G发生缩聚反应可生成H,写出该反应的化学方程式______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知热化学方程式:2H2(g)+O2(g) ![]() 2H2O(l) H= -571.6 kJ·mol-1,2CH3OH(l)+3O2(g)
2H2O(l) H= -571.6 kJ·mol-1,2CH3OH(l)+3O2(g) ![]() 2CO2(g)+4H2O(l) H= -1452 kJ·mol-1,H+(aq)+OH-(aq)
2CO2(g)+4H2O(l) H= -1452 kJ·mol-1,H+(aq)+OH-(aq) ![]() H2O(l) H= -57.3 kJ·mol-1。据此判断下列说法正确的是
H2O(l) H= -57.3 kJ·mol-1。据此判断下列说法正确的是
A. CH3OH的燃烧热为1452 kJ·mol-1
B. 2H2(g)+O2(g) ![]() 2H2O(g) H > -571.6 kJ·mol-1
2H2O(g) H > -571.6 kJ·mol-1
C. CH3COOH(aq)+NaOH(aq) ![]() H2O(l)+CH3COONa(aq) H= -57.3 kJ·mol-1
H2O(l)+CH3COONa(aq) H= -57.3 kJ·mol-1
D. 2CH3OH(l)+O2(g) ![]() 2CO2(g)+4H2(g) H= -880.4 kJ·mol-1
2CO2(g)+4H2(g) H= -880.4 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将NO2装入带有活塞的密闭容器中,当反应2NO2(g)![]() N2O4(g)达到平衡后,改变下列一个条件,下列叙述正确的是
N2O4(g)达到平衡后,改变下列一个条件,下列叙述正确的是
A. 升高温度,气体颜色加深,则此反应为吸热反应
B. 慢慢压缩气体体积,平衡向正反应方向移动,混合气体的颜色变浅
C. 慢慢压缩气体体积,若体积减小一半,压强增大,但小于原来的两倍
D. 恒温恒容时,充入稀有气体,压强增大,平衡向正反应方向移动,混合气体的颜色变浅
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】治理SO2、CO、NOx污染是化学工作者研究的重要课题。
Ⅰ.软锰矿(MnO2)、菱锰矿(MnCO3)吸收烧结烟气中的SO2制取硫酸锰。pH值对SO2吸收率的影响如图所示。在吸收过程中,氧气溶解在矿浆中将 H2SO3氧化成硫酸。

(1)SO2的吸收率在pH=_____效果最佳,MnO2所起的作用是_______,菱锰矿作为调控剂与硫酸反应, 确保pH的稳定,该反应的化学方程式为___________。
Ⅱ.沥青混凝土可作为2CO(g)+O2(g)![]() 2CO2(g)反应的催化剂。图表示在相同的恒容密闭容器、相同起始浓度、相同反应时间段下,使用同质量的不同沥青混凝土(α型、β型)催化时,CO的转化率与温度的关系。
2CO2(g)反应的催化剂。图表示在相同的恒容密闭容器、相同起始浓度、相同反应时间段下,使用同质量的不同沥青混凝土(α型、β型)催化时,CO的转化率与温度的关系。

(2)CO转化反应的平衡常数K(a)____K(c)(填“>”“<”或“=”,下同),在均未达到平衡状态时,同温下β型沥青混凝土中CO转化速率___α型,e点转化率出现突变的原因可能是______。
Ⅲ.N2H4是一种具有强还原性的物质。燃烧过程中释放的能量如下:(已知a>b)
① N2H4(g)+2O2(g) == NO2(g)+1/2N2(g)+2H2O(g) ΔH1=a kJ·mol-1
② N2H4(g)+2O2(g) == 2NO(g)+2H2O(g) ΔH2=b kJ·mol-1
(3)已知反应活化能越低,反应速率越大。假设某温度下,反应Ⅰ的速率(v1)大于反应Ⅱ的速率(v2),则下列反应过程能量变化示意图正确的是______。


(4)试写出NO(g)分解生成N2(g)和NO2(g)的热化学方程式为_____________。
Ⅳ.某含钴催化剂可以催化消除柴油车尾气中的碳烟(C)和NOx。不同温度下,将模拟尾气(成分如下表所示)以相同的流速通过该催化剂,测得所有产物(CO2、N2、N2O)与NO的相关数据结果如下图所示。
模拟尾气 | 气体(10mol) | 碳烟 | ||
NO | O2 | He | ||
物质的量(mol) | 0.025 | 0.5 | 9.475 | n |
(5)375℃时,测得排出的气体中含0.45 molO2和0.0525mol CO2,则Y的化学式为_____。实验过程中不采用NO2的模拟NOx原因是_________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,在容积为1L的密闭容器中充入![]() 和
和![]() 发生
发生![]() 测得
测得![]() 的物质的量随时间的变化如图所示,(已知,此温度下,该反应的平衡常数
的物质的量随时间的变化如图所示,(已知,此温度下,该反应的平衡常数![]() )下列说法正确的是 ( )
)下列说法正确的是 ( )
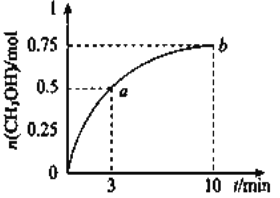
A. ![]()
B. 点b所对应的状态为化学平衡状态
C. ![]() 的生成速率,点a低于点b
的生成速率,点a低于点b
D. 欲增大平衡状态时![]() ,可保持其他条件不变,升高温度
,可保持其他条件不变,升高温度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向lL0.lmol·L-1一元酸HR溶液中逐渐通人氨气[已知常温下Kb(NH3H2O)=1.76×10-5],使溶液温度和体积保持不变,混合溶液的pH与离子浓度变化的关系如右图所示。下列叙述正确的是( )
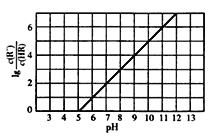
A. 0.1 mol·L-1HR溶液的pH约为3
B. HR为弱酸,常温时Ka (HR)=1×l0-7
C. 当通入0.1molNH3时,c(R-)>c(NH4+)
D. 当c(HR) =c(R-)时,溶液必为中性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,把1 mol N2O4气体通入体积为10 L的真空密闭容器中,立即出现红棕色,反应进行4 s时,NO2的浓度为0.04 mol·L-1,再经过一定时间后,反应达到平衡,这时容器内的压强为开始时的1.8倍。则下列说法正确的是( )
A.前4 s以N2O4的浓度变化表示的平均反应速率为0.01 mol·L-1·s-1
B.4 s时容器内的压强为开始时的1.2倍
C.平衡时容器内含0.4 mol N2O4
D.平衡时容器内含0.8 mol NO2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com