
【题目】一定温度下,在体积恒定的密闭容器中发生反应:![]() 。反应过程中的部分数据如下表所示:
。反应过程中的部分数据如下表所示:
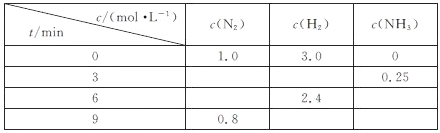
反应刚好达到平衡状态时
A. t=6min
B. c(NH3)=0.4mol·Lˉ1
C. 容器内的气体分子数N(N2):N(H2):N(NH3)=1:3:2
D. H2的正反应速率等于N2的逆反应速率
【答案】B
【解析】
由题给数据,依据化学方程式可得下列表格:
c(N2) | c(H2) | c(NH3) | |
0 | 1.0 | 3.0 | 0 |
3 | 0.875 | 2.625 | 0.25 |
6 | 0.8 | 2.4 | 0.4 |
9 | 0.8 | 2.4 | 0.4 |
由表格数据可知6min和9min时,各物质浓度保持不变,说明已达到平衡状态。
A项、6min时反应已达到平衡状态,但不能判断6min时反应刚好达到平衡状态,故A错误;
B项、达到平衡状态时,各物质浓度保持不变,则反应刚好达到平衡状态时c(NH3)=0.4 mol·Lˉ1,故B正确;
C项、容器内的气体分子数N(N2):N(H2):N(NH3)= 0.8V:2.4V:0.4V=2:6:1,故C错误;
D项、反应刚好达到平衡状态时,H2的正反应速率等于N2的逆反应速率的三倍,故D错误。
故选B。


 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源: 题型:
【题目】羰基硫(COS)是全球硫循环的重要中间体,也是有机合成中的重要原料,是化学工作者重要的研究对象。已知:
Ⅰ.COS(g)+H2(g)![]() H2S(g)+CO(g) △Hl=-17kJ/mol;
H2S(g)+CO(g) △Hl=-17kJ/mol;
Ⅱ.COS(g)+H2O(g)![]() H2S(g)+CO2(g) △H2=-35kJ/mol。
H2S(g)+CO2(g) △H2=-35kJ/mol。
回答下列问题:
(1)反应CO(g)+H2O(g)![]() H2(g)+CO2(g)的△H=________。
H2(g)+CO2(g)的△H=________。

(2)在充有催化剂的恒压密闭容器中进行反应I。设起始充入的n(COS):n(H2)=m,相同时间内测得COS转化率与m和温度(T)的关系如图所示。
①m1________m2(填>、<或=)。
②温度高于T0时,COS转化率减小的可能原因为_________。
A.有副反应发生。 B.反应的△H增大。
C.催化剂活性降低。 D.逆反应速率增大的倍数大于正反应速率增大的倍数
(3)在恒温、恒容密闭容器中.进行反应I。下列说法中能说明反应I已达到平衡状态的是____。
A.c(H2S)=c(CO) B.v正(H2)=v逆(H2S)
C.容器中气体密度保持不变 D.容器中混合气体平均摩尔质量保持不变
E.c(COS)保持不变
(4)某温度下,向体积为2 L的恒容密闭容器中通入5 mol COS(g)和5 molH2O(g),发生反应Ⅱ,5 min后反应达到平衡,测得COS(g)的转化率为60%。
①反应从起始至5 min内,用H2S浓度变化表示的平均反应速度v(H2S)=________。
②该温度下,上述反应的平衡常数K=________。
③其他条件相同时,既能使上述反应中COS的平衡转化率增大,又能使反应速率加快的做法是________。
A.缩小容器容积 B.升高温度
C.分离出硫化氢 D.加入一定量H2O(g)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某液态肼(N2H4)燃料电池被广泛应用于发射通讯卫星、战略导弹等运载火箭中。其中以固体氧化物为电解质,生成物为无毒无害的物质。下列有关该电池的说法正确的是( )

A.a电极上的电极反应式为N2H4+2O2-+4e-=N2↑+2H2O
B.电池内电路中,电流方向:电极a→电极b
C.当电极a上消耗1molN2H4时,电极b上被氧化的O2在标准状况下体积为22.4L
D.b极附近的pH值变大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】天然维生素P(结构如图)存在于槐树花蕾中,它是一种营养增补剂。关于维生素P的叙述正确的是
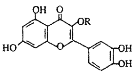
A. 若R为甲基则该物质的分子式可以表示为C16H10O7
B. lmol该化合物与NaOH溶液作用消耗NaOH的物质的量以及与氢气加成所需的氢气的物质的量分别是4mol、8mol
C. 分子中有三个苯环
D. 1mol该物质与足量溴水反应耗6molBr2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A. 硅晶体和二氧化硅晶体中都含共价键
B. 冰和干冰熔化时克服的作用力均为分子间作用力
C. 硫晶体和硫酸钠晶体均属于离子晶体
D. 氯气和四氯化碳分子中每个原子的最外电子层都形成了具有8个电子的稳定结构
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锌电池是一种极具前景的电化学储能装置。![]() 扣式可充电电池组成示意图如下。
扣式可充电电池组成示意图如下。![]() 可以在
可以在![]() 晶体中可逆地嵌入和脱除,总反应为
晶体中可逆地嵌入和脱除,总反应为![]() 。下列说法错误的是( )
。下列说法错误的是( )

A. 放电时不锈钢箔为正极,发生还原反应
B. 放电时负极的反应为![]()
C. 充电时电池正极上的反应为:![]()
D. 充电时锌片与电源的负极相连
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化氢(H2O2)溶液俗称双氧水,医疗上常用3%的双氧水进行伤口消毒。H2O2能与SO2反应生成H2SO4, H2O2的分子结构如图所示。下列说法错误的是( )

A. H2O2的结构式为H—O—O—H
B. H2O2为含有极性键和非极性键的共价化合物
C. 与SO2在水溶液中反应的离子方程式为SO2+ H2O2=2H++SO42-
D. H2O2与SO2反应过程中有共价键断裂,同时有共价键和离子键形成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水热法制备Fe3O4纳米颗粒的反应为3Fe2++2S2O32﹣+O2+xOH﹣=Fe3O4+S4O62﹣+2H2O,下列说法中不正确的是
A. 每生成1mol Fe3O4,反应转移的电子总数为4mol
B. Fe2+和S2O32﹣都是还原剂
C. x=4
D. 1mol Fe2+被氧化时,被Fe2+还原的O2的物质的量为![]() mol
mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数的值。下列说法正确的是( )
A.1molFe分别与1molCl2、1molS充分反应,转移的电子数比为3:2
B.80mL10mol/L浓盐酸与过量MnO2加热反应,生成的Cl2分子数为0.2NA
C.标准状况下,22.4mLSO3中含有的硫、氧原子个数比为1:3
D.100g63%的HNO3溶液中含有的氧原子个数为3NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com