
【题目】根据下列图示所得出的结论正确的是
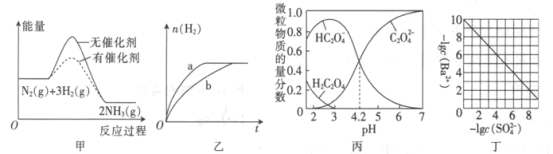
A.图甲表示.N2(g)+3H2(g)![]() 2NH3(g)反应过程的能量变化关系,说明催化剂可以改变该反应的焓变
2NH3(g)反应过程的能量变化关系,说明催化剂可以改变该反应的焓变
B.图乙表示等量的钠块分别与足量的水和乙醇反应产生氢气的物质的量随时间的变化关系,则曲线b表示水与钠的反应
C.图丙表示25℃时水溶液中H2C2O4、HC2O4-、C2O42-的物质的量分数随pH的分布,说明H2C2O4的Ka1=1×10-4.2
D.图丁表示25℃时BaSO4达到沉淀溶解平衡时,溶液中c(Ba2+)与c(SO42-)的关系曲线,说明Ksp(BaSO4)=1×10-10
【答案】D
【解析】
A、催化剂能够降低反应的活化能,但是不能改变焓变,焓变只与反应物和生成物的总能量有关,与反应途径无关,A错误;
B、钠与水反应的速率比钠与乙醇反应的速率快,生成相同体积的氢气,钠与水反应所需的时间更短,曲线a表示水与钠的反应,B错误;
C、H2C2O4![]() HC2O4-+H+,HC2O4-
HC2O4-+H+,HC2O4-![]() C2O42-+H+,
C2O42-+H+,![]() ,
,![]() ,当c(C2O42-)=c(C2O4-),Ka2=c(H+),从图中可以看出,当c(C2O42-)=c(C2O4-),pH=4.2,c(H+)=10-4.2,则Ka2=1×10-4.2,C错误;
,当c(C2O42-)=c(C2O4-),Ka2=c(H+),从图中可以看出,当c(C2O42-)=c(C2O4-),pH=4.2,c(H+)=10-4.2,则Ka2=1×10-4.2,C错误;
D、BaSO4达到沉淀溶解平衡时,溶液中c(Ba2+)与c(SO42-)的关系有,![]() ,左右同时取10的对数,有
,左右同时取10的对数,有![]() ,lgc(Ba2+)= lg(Ksp)- lgc(SO42-),为一次函数曲线,曲线符合。求算Ksp,取曲线上的点,如- lgc(Ba2+)=10,- lgc(SO42-)=0,带入等式,得lg(Ksp)=-10,则Ksp=10-10,D正确;
,lgc(Ba2+)= lg(Ksp)- lgc(SO42-),为一次函数曲线,曲线符合。求算Ksp,取曲线上的点,如- lgc(Ba2+)=10,- lgc(SO42-)=0,带入等式,得lg(Ksp)=-10,则Ksp=10-10,D正确;
答案选D。


科目:高中化学 来源: 题型:
【题目】元素周期表的形式多种多样,如下图所示是扇形元素周期表的一部分(1~36号元素),对比中学常见元素周期表,思考扇形元素周期表的填充规律,下列说法不正确的是

A. 简单离子半径:②>⑧>⑨
B. 简单氢化物的稳定性:⑤>⑧
C. 最高价氧化物对应的水化物的酸性:⑨>⑧>⑦
D. ①与⑤可形成既含极性键又含非极性键的化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丁苯酞是我国自主研发的一类用于治疗急性缺血性脑卒中的新药。合成丁苯酞(J)的一种路线如图所示:
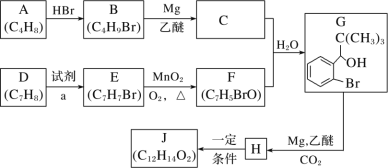
已知:
(1)B 的化学名称是_____,F 中含氧官能团名称是_____。
(2)由 E 生成 F 和 H 生成J 的反应类型分别是_____、_____。
(3)试剂 a 是_____。
(4)J 是一种环酯,则J 的结构简式为_____。H 在一定条件下还能生成高分子化合物 K,H 生成K 的化学方程式为:_____________________。
(5)M 的组成比 F 多 1 个 CH2 基团,M 的分子式为 C8H7BrO,M 的同分异构体①能发生银镜反应;②含有苯环;③不含甲基。满足上述条件的M 的同分异构体共有_____种。
(6)利用题中信息写出以乙醛和苯为原料,合成![]() 的流程图(其他试剂自选)。______________
的流程图(其他试剂自选)。______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素![]() 、
、![]() 、
、![]() 和
和![]() 的原子序数依次增大。
的原子序数依次增大。![]() 原子是元素周期表中半径最小的原子,
原子是元素周期表中半径最小的原子,![]() 原子的最外层电子数是内层电子数的3倍,元素
原子的最外层电子数是内层电子数的3倍,元素![]() 与
与![]() 同主族,
同主族,![]() 原子的最外层电子数是其电子层数的2倍。下列说法正确的是
原子的最外层电子数是其电子层数的2倍。下列说法正确的是
A.四种元素在自然界中都有游离态
B.![]() 分别与
分别与![]() 、
、![]() 、
、![]() 都可组成具有漂白性的物质,且它们的漂白原理相同
都可组成具有漂白性的物质,且它们的漂白原理相同
C.元素![]() 的氯化物中,各原子均满足最外层8电子的稳定结构
的氯化物中,各原子均满足最外层8电子的稳定结构
D.元素![]() 可与元素
可与元素![]() 形成一种既含离子键又含共价键的离子化合物
形成一种既含离子键又含共价键的离子化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,0.1 mol·L-1Na2S溶液中存在着水解平衡:S2-+H2O![]() HS-+OH-。下列说法正确的是( )
HS-+OH-。下列说法正确的是( )
A.加水稀释后恢复至常温,水解平衡正向移动,水解平衡常数增大
B.通入NH3,平衡正向移动
C.滴加少量AgNO3溶液,平衡逆向移动
D.升高温度,c(HS-)/c(S2-)减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学概念在逻辑上存在如图关系,对下列概念的说法正确的是( )

A. 化合物与氧化物属于交叉关系
B. 单质与非电解质属于包含关系
C. 溶液与分散系属于并列关系
D. 化合物与电解质属于包含关系
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组在T1温度下,容积为1 L的恒容密闭容器中,同时通入0.1 mol CO(g)和0.1 mol H2O(g),发生反应:CO(g)+H2O(g)![]() CO2(g)+H2(g) △H=a kJ· mol-1。测得CO2的物质的量浓度随时间的变化关系如图所示。
CO2(g)+H2(g) △H=a kJ· mol-1。测得CO2的物质的量浓度随时间的变化关系如图所示。
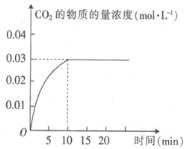
(1)0~10min内,CO的平均反应速率为_______________。
(2)T1温度下,该反应的平衡常数K为________(用分数表示)。
(3)①已知:
I.H2的燃烧热△H=-285.8 kJ· mol-1;
II.CO的燃烧热△H=-283 kJ· mol-1;
III.H2O(g)=H2O(l) △H=-44 kJ· mol-1。
则a=_______。
②反应达到平衡后,下列措施能使平衡向正反应方向移动的是__________(填字母)。
A 升高温度 B 增大压强 C 通入H2O(g) D 移走CO2(g)
(4)T1温度下,某时刻另一实验小组测得反应容器中有关数据为c(CO)=0.6 mol·L-1、c(H2O)=1.6 mol·L-1,c(H2)=0.4 mol·L-1,c(CO2)=0.4 mol·L-1,则该反应在下-时刻将____(填“向正反应方向进行”“向逆反应方向进行”或“达到平衡”),判断依据是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙烯是一种重要的基础化工原料,在一定条件下可发生下列转化:
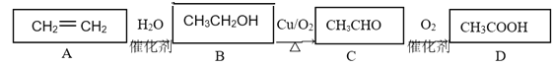
请根据题意填空:
(1)CH3COOH的官能团为________(填“羟基”或“羧基”);
(2)既能使溴水褪色,又能使酸性高锰酸钾溶液褪色的是________(填“A”或“B”);
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知X为一种常见酸的浓溶液,能使蔗糖粉末变黑。A与X反应的转化关系如下图所示,其中反应条件及部分产物均已略去,则下列有关说法正确的是( )

A. X使蔗糖变黑的现象主要体现了X的强氧化性
B. 若A为铁,则足量A与X在室温下即可完全反应
C. 若A为碳单质,则将C通入少量的澄清石灰水,一定可以观察到白色沉淀产生
D. 工业上,B转化为D的反应条件为高温、常压、使用催化剂
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com