
某恒容密闭容器中, 放入一定量的NO2, 发生下列反应: 2NO2(气)  N2O4(气) ΔH<0, 达到平衡后, 若分别改变下列条件, 重新达到平衡状态后, 能够使混合气体的平均相对分子质量减小的是:( )
N2O4(气) ΔH<0, 达到平衡后, 若分别改变下列条件, 重新达到平衡状态后, 能够使混合气体的平均相对分子质量减小的是:( )
| A.通入N2 | B.通入NO2 | C.升高温度 | D.通入N2O4 |
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| c(H2SO3) | c(HSO3-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、此时Y的浓度为0.6mol/L | B、5min 内v(X)=0.06mol/(L?min) | C、容器内X、Y、Z的浓度之比为1:2:2,则该反应达到平衡状态 | D、单位时间消耗0.1 molX同时生成0.2molZ,则该反应达到平衡状态 |
查看答案和解析>>
科目:高中化学 来源:2015届福建省福州市八县高二上学期期末考试化学试卷(解析版) 题型:填空题
化学反应原理在科研和生产中有广泛应用。
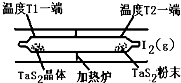
(1)利用“化学蒸气转移法”制备TaS2晶体,发生如下反应:
TaS2(s)+2I2(g) TaI4(g)+S2(g) (Ⅰ)
TaI4(g)+S2(g) (Ⅰ)
某温度反应(Ⅰ)的K=4,向某恒容密闭容器中加入1mol I2(g)和足量TaS2(s),I2(g)的平衡转化率为 。
(2)如下图所示,反应(Ⅰ)在石英真空管中进行,先在温度高(T2)的一端放入未提纯的TaS2粉末和少量I2(g),加热一段时间后,在另一端温度低(T1)的一端得到了纯净的TaS2晶体,则该正反应的△H 0(填“>”或“<”),上述反应体系中循环使用的物质是 。
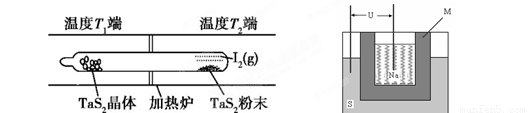
(3)上图为钠硫高能电池的结构示意图。该电池的工作温度为320℃左右,电池反应为2Na + xS=Na2Sx,正极的电极反应式为____________________________。M(由Na2O和Al2O3制得)的两个作用是________________________________________________和隔离钠与硫。
(4)写出Na2S溶液水解的离子方程式_______________________________________ ,Na2S溶液中c(H+)+ c(Na+)=________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com