
抗酸药物的种类很多,其有效成分一般都是碳酸氢钠、碳酸钙、碳酸镁、氢氧化铝和氢氧化镁等化学物质。
(1)抗酸药物具有抗酸作用的原因是______________________________________________。
(2)某品牌抗酸药的主要成分有糖衣、碳酸镁、氢氧化铝、淀粉。
①写出该抗酸药发挥功效时的离子方程式:______________________________、______________________________。
②淀粉在抗酸药中作填充剂、黏合剂,淀粉在人体内酶的催化作用下发生水解反应,最终转化为(写结构简式)______________________________。
(1)与胃酸反应,消耗了胃酸 ; (2)①Al(OH) 3 +3H + ====Al 3+ +3H 2 O MgCO 3 +2H + ====Mg 2+ +H 2 O+CO 2 ↑;②CH 2 OH(CHOH) 4 CHO
【解析】
试题分析:(1)碳酸氢钠、碳酸钙、碳酸镁、氢氧化铝和氢氧化镁都能中和胃里过多的盐酸,故填:抗酸药物有效成分能中和胃里过多的盐酸;(2)①碳酸镁和盐酸反应生成氯化镁、水和二氧化碳,反应的离子方程式为:MgCO3+2H+═Mg2++CO2↑+H2O;氢氧化铝和盐酸反应生成氯化铝和水,反应的离子方程式为:Al(OH)3+3H+═Al3++3H2O,故答案为:MgCO3+2H+═Mg2++CO2↑+H2O;Al(OH)3+3H+═Al3++3H2O; ②淀粉在人体内在酶的作用水解最终转化成葡萄糖,其化学式为:C6H12O6,答案为CH 2 OH(CHOH) 4 CHO.
考点:离子方程式书写


科目:高中化学 来源:2014-2015学年吉林省高一上学期期中考试化学试卷(解析版) 题型:选择题
已知 2Fe3+ +2I- =2Fe2+ +I2 2Fe2++Cl2 =2Fe3+ +2Cl-
则有关离子的还原性由强到弱的顺序为( )
A.Cl->Fe2+>I- B. Fe2+>I->Cl-
C.I->Fe2+>Cl- D.Fe2+>Cl->I-
查看答案和解析>>
科目:高中化学 来源:2014-2015学年吉林省高二上学期模块一测试化学试卷(解析版) 题型:选择题
常温时,pH值为3的CH3COOH和pH为11的NaOH溶液等体积混合,混合后溶液pH为( )
A. pH>7 B.pH< 7 C.pH=7 D.无法判断
查看答案和解析>>
科目:高中化学 来源:2014-2015学年吉林省高一上学期模块一测试化学试卷(解析版) 题型:选择题
配制 500g质量分数为14.6%的盐酸,需要标准状况下HCl气体的体积是( )
A. 22.4L B. 33.6L C. 44.8L D.46L
查看答案和解析>>
科目:高中化学 来源:2014-2015学年吉林省高一上学期模块一测试化学试卷(解析版) 题型:选择题
现有一瓶A和B的混合液,已知它们的性质如下表,据此分析,将A和B相互分离的常用方法是 ( )
物质 | 熔点/℃ | 沸点/℃ | 密度/g·cm-3 | 溶解性 |
A | -11.5 | 198 | 1.11 | A、B互溶, 且均易溶于水 |
B | 17.9 | 290 | 1.26 |
A.蒸馏 B.分液 C.过滤 D.蒸发
查看答案和解析>>
科目:高中化学 来源:2014-2015学年吉林省高二9月月考化学试卷(解析版) 题型:填空题
某同学欲检验抗酸药中是否含有Al(OH) 3 ,操作如下:取药剂3~4片研碎,向样品中加入过量的盐酸,过滤,得澄清溶液,向澄清溶液中滴加NaOH溶液,观察到有白色沉淀,继续加过量NaOH溶液,白色沉淀又溶解。你能得出该抗酸药中__________(填“含”或“不含”)有Al(OH) 3 ,请写出有关反应的化学方程式:
(1)_________________________________________________________________________;
(2)_________________________________________________________________________;
(3)_________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年吉林省高二9月月考化学试卷(解析版) 题型:填空题
味精是烹制菜肴时常用的调味品,其主要成分是谷氨酸钠(化学式为C 5 H 8 NO 4 Na)。谷氨酸钠有鲜味,易溶于水。某品牌味精包装上标注:“谷氨酸钠含量≥80%,NaCl含量<20%”。
某学校化学科研小组对此味精中NaCl的含量进行测定。
Ⅰ.查阅资料:谷氨酸钠的存在不影响NaCl含量的测定。
Ⅱ.设计实验方案:
(1)实验原理:通过味精与硝酸银反应生成氯化银的质量计算该味精中NaCl的质量分数。
(2)实验试剂:水、AgNO 3 溶液等
(3)实验过程:
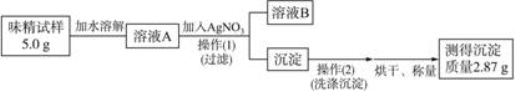
①操作(Ⅰ)所需要的玻璃仪器有____________________。
②通过计算判断该味精中NaCl的质量分数是__________,判断该味精中NaCl __________(填“符合”或“不符合”)其包装上标注的标准。
③若溶液A的体积为50 mL,则其中NaCl的物质的量浓度为____________________。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年吉林省高一入学摸底考试化学试卷(解析版) 题型:计算题
某校化学兴趣小组为测定空气中二氧化硫的含量,用NaOH溶液吸收SO2 ,反应方程式如下:
2NaOH+SO2 ==Na2SO3 + H2O
用NaOH溶液吸收1000L已除去CO 2 的空气样品,溶液质量增重了0.64g,已知此时空气的密度约为1.3g/L,求:
(1)被吸收的SO 2 质量. (2)发生反应的NaOH的质量.
(3)空气中SO2的质量分数(计算结果精确到0.01%) .
查看答案和解析>>
科目:高中化学 来源:2014-2015学年吉林延边州汪清六中上第一次月考高一化学试卷(解析版) 题型:选择题
(3分)1mol?L﹣1硫酸溶液的含义是( )
A. 1L水中含有1mol硫酸 B. 1L溶液中含1mol H+
C.将98g硫酸溶于1L水所配成的溶液 D. 指1L硫酸溶液中含有98g H2SO4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com