
【题目】美国研究人员将 CO 和氧原子附着在一种铁催化剂表面,用激光脉冲将其加热到 2000K,成功观察到CO 与氧原子形成化学键生成CO2的全过程。下列说法正确的是( )
A. CO、CO2均属于酸性氧化物
B. O2断键形成氧原子时需放出能量
C. CO 与氧原子形成化学键生成CO2 需要吸收能量
D. CO 与氧原子形成化学键过程中有电子转移
 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案科目:高中化学 来源: 题型:
【题目】下列有关元素周期表的说法正确的是( )
A. 元素周期表有8个主族 B. 短周期是指第1、2、3周期
C. ⅠA族的元素全是金属元素 D. 0族原子的最外层电子数均为8
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列配制的溶液浓度偏高的是( )
A.配制盐酸溶液,用量筒取盐酸时俯视刻度线
B.配制盐酸溶液定容时,仰视容量瓶
C.称量4gNaOH配制0.20mol/L NaOH溶液500mL时,砝码错放左盘
D.配制NaOH溶液时,溶液未经冷却即注入容量瓶并定容至刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二甲醚(CH3OCH3)是一种清洁、高效、具有优良的环保性能的可燃物,被称为21世纪的新型能。工业制备二甲醚的生产流程如下:
催化反应室中(压力2.0~10.0MPa,温度300℃)进行下列反应:
(Ⅰ)CO(g)+2H2(g) ![]() CH3OH(g) ΔH1=-90.7kJ·mol-1
CH3OH(g) ΔH1=-90.7kJ·mol-1
(Ⅱ)2CH3OH(g) ![]() CH3OCH3(g)+H2O(g) ΔH2=-23.5kJ·mol-1
CH3OCH3(g)+H2O(g) ΔH2=-23.5kJ·mol-1
(Ⅲ)CO(g)+H2O(g) ![]() CO2(g)+H2(g) ΔH3=-41.2kJ·mol-1
CO2(g)+H2(g) ΔH3=-41.2kJ·mol-1
(1)催化反应室中的总反应:3CO(g)+3H2(g) ![]() CH3OCH3(g)+CO2(g)
CH3OCH3(g)+CO2(g)
①该反应的反应热△H=__________。
②催化反应室中采用300℃的反应温度,理由是______________________________。
(2)已知:反应(Ⅰ)在300℃时的化学平衡常数为0.27。该温度下将2molCO、3molH2和2molCH3OH充入容积为2L的密闭容器中,此时反应将__________(填“正向进行”、“逆向进行”或“处于平衡状态”)。
(3)上述流程中二甲醚精制的实验操作名称为____________________。
(4)如图为绿色电“二甲醚燃料电池”的工作原理示意图。
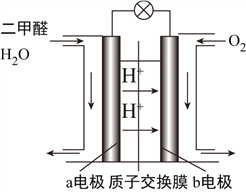
①该电池工作时,H+向__________极移动(填“正”或“负”);
②a电极的电极反应式为________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为研究1.0mol/LFe(NO3)3溶液与Cu的反应,甲与乙做了如下实验:将Cu片放入1.0mol/L的Fe(NO3)3溶液中,观察到Cu片逐渐溶解,溶液变为蓝绿色,由此甲得出结论:Fe(NO3)3溶液中的Fe3+氧化了Cu。而乙认为,Fe(NO3)3溶液显酸性,此酸性条件下,NO3-也能氧化Cu。
(1)甲为证明自己的观点,设计如下实验:
步骤 | 操作 | 现象 |
Ⅰ | 取蓝绿色溶液,向其中加入K3[Fe(CN)6]溶液 | …… |
①请用离子方程式解释,Fe(NO3)3溶液显酸性的原因__________。
②证明甲观点正确的现象是__________,Fe3+与Cu反应的离子方程式为__________。
(2)乙证明自己的观点,设计如下实验:
步骤 | 操作 | 现象 |
Ⅱ | 用pH试纸测定1.0mol/L的Fe(NO3)3溶液的pH值 | 1.0mol/L的Fe(NO3)3溶液的pH=1 |
Ⅲ | 将1.0mol/L的Fe(NO3)3溶液替换为某种溶液(或混合溶液),加入Cu | …… |
①下列溶液中,可以用于替换上述Fe(NO3)3溶液的是__________(填序号)
a.0.1mol/LHNO3溶液
b.0.1mol/LFeCl3溶液
c.6.0mol/LNaNO3和0.2mol/L盐酸等体积混合后的溶液
②测定溶液pH值的操作是__________。
③乙查阅资料:NO3-在不同条件下的还原产物较复杂,有时难以观察到气体产生。证明乙观点正确的现象是__________。
(3)研究发现,甲和乙的观点都正确。丙得出结论:将Cu片放入1.0mol/L的Fe(NO3)3溶液中,Fe3+和NO3-均氧化的Cu。你是否同意丙的结论,理由是__________。
(4)为进一步研究1.0mol/LFe(NO3)3溶液与Cu的反应,甲与乙查阅资料:
水解反应 | 平衡常数(K) |
Fe3++3H2O | 7.9×10-4 |
Fe2++2H2O | 3.2×10-10 |
Cu2++2H2O | 3.2×10-7 |
甲与乙再次将Cu片放入1.0mol/L的Fe(NO3)3溶液中,并监测实验过程中溶液pH值的变化。他们发现Cu片逐渐溶解,溶液变为蓝绿色,且pH值略有上升。由此可以得出结论:__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素甲、乙、丙、丁的原子序数依次增大,甲和乙形成的气态化合物的水溶液呈碱性,乙位于第 VA 族,甲和丙同主族,丁原子最外层电子数与电子层数相等,则( )
A. 原子半径:丁>丙>乙
B. 单质的还原性:丁>丙>甲
C. 甲、乙、丙的氧化物均为共价化合物
D. 乙、丙、丁的最高价氧化物对应的水化物能相互反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铅笔芯的主要成分是石墨和黏土,这些物质按照不同的比例加以混和、压制,就可以制成铅笔芯.如果铅笔芯质量的一半成分是石墨,且用铅笔写一个字消耗的质量约为1mg.那么一个铅笔字含有的碳原子数约为( )
A.2.5×1019个
B.2.5×1022个
C.5×1019个
D.5×1022个
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com