
【题目】二甲醚(CH3OCH3)是一种清洁、高效、具有优良的环保性能的可燃物,被称为21世纪的新型能。工业制备二甲醚的生产流程如下:
催化反应室中(压力2.0~10.0MPa,温度300℃)进行下列反应:
(Ⅰ)CO(g)+2H2(g) ![]() CH3OH(g) ΔH1=-90.7kJ·mol-1
CH3OH(g) ΔH1=-90.7kJ·mol-1
(Ⅱ)2CH3OH(g) ![]() CH3OCH3(g)+H2O(g) ΔH2=-23.5kJ·mol-1
CH3OCH3(g)+H2O(g) ΔH2=-23.5kJ·mol-1
(Ⅲ)CO(g)+H2O(g) ![]() CO2(g)+H2(g) ΔH3=-41.2kJ·mol-1
CO2(g)+H2(g) ΔH3=-41.2kJ·mol-1
(1)催化反应室中的总反应:3CO(g)+3H2(g) ![]() CH3OCH3(g)+CO2(g)
CH3OCH3(g)+CO2(g)
①该反应的反应热△H=__________。
②催化反应室中采用300℃的反应温度,理由是______________________________。
(2)已知:反应(Ⅰ)在300℃时的化学平衡常数为0.27。该温度下将2molCO、3molH2和2molCH3OH充入容积为2L的密闭容器中,此时反应将__________(填“正向进行”、“逆向进行”或“处于平衡状态”)。
(3)上述流程中二甲醚精制的实验操作名称为____________________。
(4)如图为绿色电“二甲醚燃料电池”的工作原理示意图。
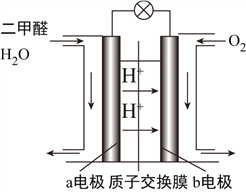
①该电池工作时,H+向__________极移动(填“正”或“负”);
②a电极的电极反应式为________________________________________。
【答案】 (1)①-246.1KJ/mol, 提高化学反应速率 逆向进行 蒸馏 正 CH3OCH3-12e-+3H2O=2CO2+12H+
【解析】(1)①已知:(Ⅰ)CO(g)+2H2(g)CH3OH(g)△H=-90.7kJ/mol,(Ⅱ)2CH3OH(g)CH3OCH3(g)+H2O(g)△H=-23.5kJ/mol,(Ⅲ)CO(g)+H2O(g)CO2(g)+H2(g)△H=-41.2kJ/mol,由盖斯定律可知,Ⅰ×2+Ⅱ+Ⅲ得3CO(g)+3H2(g)CH3OCH3(g)+CO2(g)△H= -246.1kJ/mol;
②反应放热,高温不利用原料的利用,温度低原料利用率高,但反应较慢,不利于实际生产,采用300℃的反应温度,目的(保证催化剂的活性最大),提高化学反应速率;
(2)该温度下将2mol CO、3mol H2和2mol CH3OH充入容积为2L的密闭容器中,此时c(CO)=1mol/L,c(H2)=1.5mol/L,c(CH3OH)=1mol/L,浓度商Qc=![]() =0.44,大于平衡常数0.27,故反应向逆反应进行;
=0.44,大于平衡常数0.27,故反应向逆反应进行;
(3)二甲醚、乙醇、水为互溶的液体,沸点不同,采取蒸馏的方法将二甲醚分离;
(4)①反应本质是二甲醚的燃烧,原电池负极发生氧化反应,二甲醚在负极放电,正极反应还原反应,氧气在正极放电,由图可知,氢离子移向b电极,b电极正极;
②a极为负极,二甲醚放电生成二氧化碳与氢离子,a电极的电极反应式为 CH3OCH3-12e-+3H2O=2CO2+12H+。


科目:高中化学 来源: 题型:
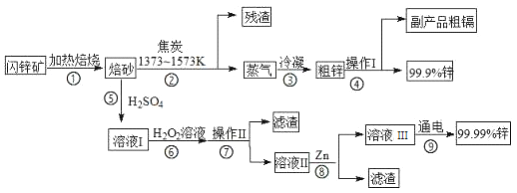
【题目】闪锌矿(主要成分ZnS,含Cd、Fe、Cu等元素杂质)是冶炼锌单质的原料,有两种常见的冶炼方式:火法炼锌和湿法炼锌。两种方法均先将闪锌矿加热焙烧,得到以ZnO为主要成分的焙砂,再分别经过两条路线得到单质锌,同时得到副产品。
已知:
(I)相关金属单质的熔沸点
金属单质 | Zn | Fe | Cu | Cd |
熔点 (K) | 693 | 1812 | 1356 | 594 |
沸点 (K) | 1180 | 3023 | 2840 | 1040 |
(II)几种离子生成氢氧化物沉淀的pH
Fe3+ | Zn2+ | Cu2+ | Cd2+ | |
开始沉淀pH | l.l | 5.9 | 4.7 | 6.9 |
完全沉淀pH | 3.2 | 8.9 | 6.7 | 9.6 /span> |
请回答下列问题:
(1) 步骤②若焦炭与ZnO(s)反应生成1mol CO时吸收akJ的热量,请写出该反应的热化学方程式___________________________________________________。
(2)步骤④中操作I的分离方法为蒸馏,得到副产品粗镉需控制温度为____左右。
(3)步骤⑦需调节溶液pH为_______,目的是_____________________________。
(4)写出步骤⑧中反应的离子方程式___________________________(任写一个)
(5)步骤⑨以Pt为电极进行电解,阴极的电极反应方程式为________________。
(6)分别取闪锌矿200kg,通过火法炼锌得到Zn的质量为65kg,通过湿法炼锌得到Zn的质量为78kg,闪锌矿中ZnS的质量分数约为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丙烷燃烧可以通过以下两种途径:
途径I:C3H8(g) + 5O2(g) == 3CO2(g) +4H2O(l) ΔH=-a kJ·mol-1
途径II:C3H8(g) ==C3H6(g)+ H2(g) ΔH=+b kJ·mol-1
2C3H6(g)+ 9O2(g) == 6CO2(g) +6H2O(l) ΔH=-c kJ·mol-1
2H2(g)+O2(g) == 2H2O(l) ΔH=-d kJ·mol-1(a、b、c、d均为正值)
请回答下列问题:
(1)判断等量的丙烷通过两种途径放出的热量,途径I放出的热量 ______(填“大于”、“等于”或“小于”)途径II放出的热量。
(2)由于C3H8(g) ==C3H6(g)+ H2(g) 的反应中,反应物具有的总能量______(填“大于”、“等于”或“小于”)生成物具有的总能量,那么在化学反应时。反应物就需要______(填“放出”、或“吸收”)能量才能转化为生成物,因此其反应条件是______________。
(3)b 与a、c、d的数学关系式是______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据题意填空
(1)在 KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O 的反应中,氧化剂是 , 还原产物是 , 氧化产物与还原产物的质量比是 .
(2)在反应MnO2+4HCl=MnCl2+Cl2↑+2H2O中,每生成标准状况下4.48LCl2 , 转移的电子的物质的量为mol.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】美国研究人员将 CO 和氧原子附着在一种铁催化剂表面,用激光脉冲将其加热到 2000K,成功观察到CO 与氧原子形成化学键生成CO2的全过程。下列说法正确的是( )
A. CO、CO2均属于酸性氧化物
B. O2断键形成氧原子时需放出能量
C. CO 与氧原子形成化学键生成CO2 需要吸收能量
D. CO 与氧原子形成化学键过程中有电子转移
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于相同物质的量的SO2和SO3 , 下列说法中正确的是( )
A.硫元素的质量比为5:4
B.分子数之比为1:1
C.原子总数之比为4:3
D.质量之比为1:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2A+B![]() 3C+5D反应中,表示该反应速率最快的是 ( )。
3C+5D反应中,表示该反应速率最快的是 ( )。
A. υ(A)= 0.5 mol/(L·s) B. υ(B)= 0.3 mol/(L·s)
C. υ(C)= 0.8 mol/(L·s) D. υ(D)= 1 mol/(L·s)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素X、Y、Z、Q、T的原子序数与其常见化合价关系如图所示。下列说法正确的是( )
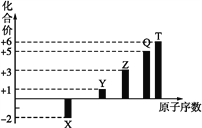
A. 1 mol TX2与足量X2反应生成TX3的分子数目为NA
B. Z元素形成的可溶性盐溶液可能显碱性
C. 1 mol Y2X2与足量H2O反应转移的电子数目为2NA
D. 0.1 mol Q元素的含氧酸在水中电离出的H+数目为3NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com