
【题目】根据题意填空
(1)在 KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O 的反应中,氧化剂是 , 还原产物是 , 氧化产物与还原产物的质量比是 .
(2)在反应MnO2+4HCl=MnCl2+Cl2↑+2H2O中,每生成标准状况下4.48LCl2 , 转移的电子的物质的量为mol.
【答案】
(1)KClO3;Cl2;5:1
(2)0.4
【解析】解:(1)反应中KClO3+6HCl=KCl+3Cl2↑+3H2O中,只有Cl元素化合价发生变化,KClO3为氧化剂,HCl为还原剂,当有1mol Cl2生成时,氧化产物与还原产物的质量之比为 ![]() mol:
mol: ![]() mol=5:1, 所以答案是:KClO3;Cl2;5:1;(2)氧化还原反应MnO2+4HCl=MnCl2+Cl2↑+2H2O中,失电子的元素氯元素,化合价升高,得电子的元素锰元素,化合价降低,化合价降低数目=化合价升高数目=转移的电子数目=2mol,所以每生成标准状况下4.48LCl2 , 转移的电子的物质的量为
mol=5:1, 所以答案是:KClO3;Cl2;5:1;(2)氧化还原反应MnO2+4HCl=MnCl2+Cl2↑+2H2O中,失电子的元素氯元素,化合价升高,得电子的元素锰元素,化合价降低,化合价降低数目=化合价升高数目=转移的电子数目=2mol,所以每生成标准状况下4.48LCl2 , 转移的电子的物质的量为 ![]() ×2=0.4mol,
×2=0.4mol,
所以答案是:0.4.


 字词句段篇系列答案
字词句段篇系列答案科目:高中化学 来源: 题型:
【题目】国际能源网报道:金属燃料可能成为新能源,可能带来结束化石能源时代的希望,是一种理想的储能方式。下列说法不正确的是( )
A.钠米金属燃料,更易点燃
B.铁作燃料时,可用磁性材料吸引生成物,便于产物分离
C.镁可以通过2Mg+CO2=2MgO+C,达到既节能减碳又释放能量的效果
D.可从海水中提取氯化镁,并使氯化镁分解获得镁并释放出能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生欲用12molL﹣1浓盐酸和蒸馏水配制500mL物质的量浓度为0.3molL﹣1的稀盐酸. ①该学生需要量取mL上述浓盐酸进行配制.
②配制过程中正确的操作顺序是(字母表示,每个字母只能用一次);
A.用少量水洗涤烧杯2~3次,洗涤液均注入容量瓶,振荡
B.用量筒准确量取所需浓盐酸,沿玻璃棒倒入烧杯中,再加入少量水,用玻璃棒慢慢搅动,使其混合均匀
C.将已冷却的盐酸沿玻璃棒注入500mL容量瓶中
D.将容量瓶盖紧,振荡,摇匀
E.改用胶头滴管加水,使溶液凹面恰好与刻度相切
F.继续往容量瓶内小心加水,直到液面接近刻度1~2cm处
③下列实验操作对所配制的稀盐酸的物质的量浓度有何影响?(在括号内填“偏大”、“偏小”、“无影响”).
a.用量筒量取浓盐酸时俯视观察凹液面
b.定容后经振荡、摇匀、静置,发现液面下降,再加适量的蒸馏水
c.稀释浓盐酸时,未冷却到室温即转移到容量瓶中
d.将量取浓盐酸的量筒进行洗涤,并将洗涤液转移到容量瓶中
e.容量瓶洗涤干净后未干燥
④若在标准状况下,将V LHCl气溶解在1L水中(水的密度近似为1g/mL),所得溶液的密度为ρ g/mL,则此溶液中HCl物质的量浓度为
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】最近媒体报道了一些化学物质,如:爆炸力极强的N5、比黄金还贵的18O、太空中的甲醇气团等。下列说法中正确的是
A.18O2和16O2是两种不同的原子B.甲醇(CH3OH)属于离子化合物
C.N5和N2是氮元素的两种同位素D.由N5变成N2是化学变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将amol/L Al2(SO4)3和钾离子浓度为2bmol/L的K2SO4混合溶液500mL加水稀释到2L,则稀释后的溶液中SO42﹣的浓度为( )
A.![]() ?mol/L
?mol/L
B.4(3a+b) mol/L
C.4(a+b) mol/L
D.![]() mol/L
mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二甲醚(CH3OCH3)是一种清洁、高效、具有优良的环保性能的可燃物,被称为21世纪的新型能。工业制备二甲醚的生产流程如下:
催化反应室中(压力2.0~10.0MPa,温度300℃)进行下列反应:
(Ⅰ)CO(g)+2H2(g) ![]() CH3OH(g) ΔH1=-90.7kJ·mol-1
CH3OH(g) ΔH1=-90.7kJ·mol-1
(Ⅱ)2CH3OH(g) ![]() CH3OCH3(g)+H2O(g) ΔH2=-23.5kJ·mol-1
CH3OCH3(g)+H2O(g) ΔH2=-23.5kJ·mol-1
(Ⅲ)CO(g)+H2O(g) ![]() CO2(g)+H2(g) ΔH3=-41.2kJ·mol-1
CO2(g)+H2(g) ΔH3=-41.2kJ·mol-1
(1)催化反应室中的总反应:3CO(g)+3H2(g) ![]() CH3OCH3(g)+CO2(g)
CH3OCH3(g)+CO2(g)
①该反应的反应热△H=__________。
②催化反应室中采用300℃的反应温度,理由是______________________________。
(2)已知:反应(Ⅰ)在300℃时的化学平衡常数为0.27。该温度下将2molCO、3molH2和2molCH3OH充入容积为2L的密闭容器中,此时反应将__________(填“正向进行”、“逆向进行”或“处于平衡状态”)。
(3)上述流程中二甲醚精制的实验操作名称为____________________。
(4)如图为绿色电“二甲醚燃料电池”的工作原理示意图。
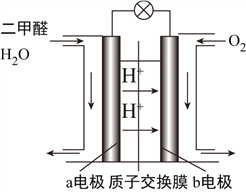
①该电池工作时,H+向__________极移动(填“正”或“负”);
②a电极的电极反应式为________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将20.0g质量分数为14.0%的KNO3溶液与30.0g质量分数为24.0%的KNO3溶液混合,得到的密度为1.15g/cm3的混合溶液.计算:
(1)混合后溶液的质量分数.
(2)混合后溶液的物质的量浓度.
(3)在1 000g水中需溶解多少摩尔KNO3才能使其浓度恰好与上述混合后溶液的浓度相等?
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是某同学设计的放热反应的观察装置。

其实验顺序是:①按图所示将实验装置连接好。
②在U形管内加入少量红墨水(或品红)溶液。打开T型管螺旋夹,使U形管内两边的液面处于同一水平面,再夹紧螺旋夹。
③在中间的试管里盛1 g氧化钙,当滴入2 mL左右的蒸馏水后,同时打开螺旋夹即可观察。
试回答:(1)实验中观察到的现象是__________________________________
(2)该实验中必须进行的一步实验操作是_____________________________
(3)该实验的原理是______________________________________________________
(4)实验中反应的化学反应方程式是______________________________________
(5)说明CaO、H2O的能量与Ca(OH)2的能量之间的关系并说明理由_________________________
(6)若该实验中CaO换成NaCl,实验还能否观察到相同现象?__________________;原因__________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com