
【题目】某学生欲用12molL﹣1浓盐酸和蒸馏水配制500mL物质的量浓度为0.3molL﹣1的稀盐酸. ①该学生需要量取mL上述浓盐酸进行配制.
②配制过程中正确的操作顺序是(字母表示,每个字母只能用一次);
A.用少量水洗涤烧杯2~3次,洗涤液均注入容量瓶,振荡
B.用量筒准确量取所需浓盐酸,沿玻璃棒倒入烧杯中,再加入少量水,用玻璃棒慢慢搅动,使其混合均匀
C.将已冷却的盐酸沿玻璃棒注入500mL容量瓶中
D.将容量瓶盖紧,振荡,摇匀
E.改用胶头滴管加水,使溶液凹面恰好与刻度相切
F.继续往容量瓶内小心加水,直到液面接近刻度1~2cm处
③下列实验操作对所配制的稀盐酸的物质的量浓度有何影响?(在括号内填“偏大”、“偏小”、“无影响”).
a.用量筒量取浓盐酸时俯视观察凹液面
b.定容后经振荡、摇匀、静置,发现液面下降,再加适量的蒸馏水
c.稀释浓盐酸时,未冷却到室温即转移到容量瓶中
d.将量取浓盐酸的量筒进行洗涤,并将洗涤液转移到容量瓶中
e.容量瓶洗涤干净后未干燥
④若在标准状况下,将V LHCl气溶解在1L水中(水的密度近似为1g/mL),所得溶液的密度为ρ g/mL,则此溶液中HCl物质的量浓度为
【答案】12.5;BCAFED;偏小;偏小;偏大;偏大;无影响;![]() mol/L
mol/L
【解析】解:①设需要浓盐酸体积为V,则稀释前后溶液中溶质的物质的量不变,可知:V×12mol/L=0.3mol/L×500mL,解得V=12.5; 故答案为:12.5;②配制一定物质的量浓度溶液的一般操作步骤:计算、量取、稀释、移液、洗涤、移液、定容、摇匀、贴签,所以正确的顺序为:BCAFED;
故答案为:BCAFED;③a.用量筒量取浓盐酸时俯视观察凹液面,导致量取的浓盐酸体积偏小,溶质的物质的量偏小,溶液浓度偏低;
故答案为:偏小;
b.定容后经振荡、摇匀、静置,发现液面下降,再加适量的蒸馏水,导致溶液体积偏大,溶液浓度偏低;
故答案为:偏小;
c.稀释浓盐酸时,未冷却到室温即转移到容量瓶中,冷却后液面下降,溶液体积偏小,溶液浓度偏高;
故答案为:偏大;
d.将量取浓盐酸的量筒进行洗涤,并将洗涤液转移到容量瓶中,导致量取的浓盐酸体积偏大,溶质的物质的量偏大,溶液的浓度偏大;
故答案为:偏大;
e.容量瓶洗涤干净后未干燥,对溶质的量和溶液体积都不产生影响,溶液浓度不变;
故答案为:无影响;④在标准状况下,将V LHCl物质的量n= ![]() mol;
mol;
标准状况下,将V LHCl气溶解在1L水中(水的密度近似为1g/mL),所得溶液的密度为ρ g/mL,则溶液的质量m=( ![]() ×36.5+1000);
×36.5+1000);
溶液的体积V= ![]() ;
;
则溶液的物质的量浓度C= ![]() =
= ![]() mol/L;
mol/L;
故答案为: ![]() .
.
①根据稀释前后溶液中溶质的物质的量不变来计算;②依据配制一定物质的量浓度溶液的一般操作步骤排序;③分析操作对溶质的物质的量和溶液体积的影响,依据C= ![]() 进行分析,凡是使n偏大或者使V偏小的操作都会使溶液浓度偏高,反之使溶液浓度偏低;④分别计算V LHCl的物质的量,和溶液的体积,注意溶液体积依据V=
进行分析,凡是使n偏大或者使V偏小的操作都会使溶液浓度偏高,反之使溶液浓度偏低;④分别计算V LHCl的物质的量,和溶液的体积,注意溶液体积依据V= ![]() 计算,依据C=
计算,依据C= ![]() 计算溶液物质的量浓度.
计算溶液物质的量浓度.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】氮化镁(Mg3N2)在工业上应用广泛,通常条件下为黄绿色粉末,极易与水反应,常用作接触媒。
I.氮化镁的制备 下面是甲、乙两位学生提出的制备氮化镁的实验方案示意图(实验前系统内的空气已排除。图中箭头表示气体的流向)。
甲. ![]()
乙. ![]()
(1)Mg3N2的电子式为___________,甲同学的实验方案不能顺利制得氮化镁,原因为________ (用化学方程式表示)。
(2)乙同学方案中NaOH固体的作用为_____________________________________________。
(3)丙同学利用空气中含有大量N2的事实,用以下装置设计了另外一种制备氮化镁的方案 (夹持装置略去):

①按气流由左到右的方向,上述装置合理的连接顺序为____________(填接口字母);
②装置B的作用为___________,装置D的作用为__________________________。
Ⅱ.定性分析产物
操作步明 | 实验现象 | 解释原因 |
取少量产品于试管中,加适量蒸馏水 | 试管底部有固体不溶物,有剌激性气味的气体产生 | (4)反应的化学方程式为___________ |
. | ||
弃去上层淸液,加入足量稀盐酸 | 观察到固体全部溶解,且有气泡冒出 | (5)气泡冒出的原因为_____________ |
Ⅲ.定量测定氮化镁纯度
i.称取4.0 g反应后的固体,加入足量水,将生成的气体全部蒸出并通入100.00mL 1.00 mol/L盐酸中,充分反应后,将所得溶液稀释到200.00mL;
ii.取20.00 mL稀释后的溶液,用0.2 mol/L NaOH标准溶液滴定过量的盐酸,达到终点时消耗标准溶液25.00 mL。
(6)产物中氮化镁的质量分数为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 金属与非金属分界线附近的元素既有金属性,又有非金属性,称为过渡元素
B. 任何元素的原子都是由核外电子和核内中子、质子组成的
C. 118号元素是由自然界中元素衰变得到的
D. 同种元素的不同核素之间互称同位素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某元素的核外有三个电子层,其最外层电子数是次外层电子数的一半,这元素位于周期表( )
A. 第4周期ⅢA族 B. 第4周期ⅦA族
C. 第3周期ⅣB族 D. 第3周期ⅣA族
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,在某密闭容器中进行如下反应:
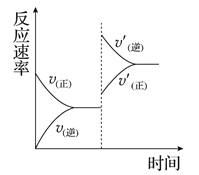
mA(g)+nB(g)![]() pC(g)+qD(g),若增大压强或升高温度,重新达到平衡,
pC(g)+qD(g),若增大压强或升高温度,重新达到平衡,
反应速率随时间的变化过程如图所示,则对该反应的叙述正确的是( )
A. 正反应是吸热反应 B. 逆反应是放热反应
C. m+n<p+q D. m+n>p+q
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丙烷燃烧可以通过以下两种途径:
途径I:C3H8(g) + 5O2(g) == 3CO2(g) +4H2O(l) ΔH=-a kJ·mol-1
途径II:C3H8(g) ==C3H6(g)+ H2(g) ΔH=+b kJ·mol-1
2C3H6(g)+ 9O2(g) == 6CO2(g) +6H2O(l) ΔH=-c kJ·mol-1
2H2(g)+O2(g) == 2H2O(l) ΔH=-d kJ·mol-1(a、b、c、d均为正值)
请回答下列问题:
(1)判断等量的丙烷通过两种途径放出的热量,途径I放出的热量 ______(填“大于”、“等于”或“小于”)途径II放出的热量。
(2)由于C3H8(g) ==C3H6(g)+ H2(g) 的反应中,反应物具有的总能量______(填“大于”、“等于”或“小于”)生成物具有的总能量,那么在化学反应时。反应物就需要______(填“放出”、或“吸收”)能量才能转化为生成物,因此其反应条件是______________。
(3)b 与a、c、d的数学关系式是______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是
A.煤焦油、石油、花生油都属于烃
B.蛋白质、脂肪、葡萄糖在一定条件下都能水解
C.甲烷、乙烯、苯都可通过石油分馏得到
D.乙醇既能与有机化合物反应又能与无机化合物反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据题意填空
(1)在 KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O 的反应中,氧化剂是 , 还原产物是 , 氧化产物与还原产物的质量比是 .
(2)在反应MnO2+4HCl=MnCl2+Cl2↑+2H2O中,每生成标准状况下4.48LCl2 , 转移的电子的物质的量为mol.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于金属腐蚀的叙述正确的是( )
A.本质是:2M +2 nH2O = 2M(OH)n+ n H2↑
B.电化学腐蚀必须在酸性条件下进行
C.化学腐蚀比电化学腐蚀更普遍
D.本质是:M – ne-= Mn+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com