
��14�֣�����һ�������£���ѧ�����ô��̵����з����CO2��̫���ܵ�ص��ˮ������H2�ϳɼ״������������ͼ��ʾ���Իش��������⣺

(1)�úϳ�·�߶��ڻ��������ļ�ֵ���� ��
(2)15��20%���Ҵ�����HOCH2CH2NH2��ˮ��Һ���������ԣ������ϳ���·������CO2���ռ��������ӷ���ʽ��ʾ�Ҵ���ˮ��Һ�������Ե�ԭ�� ��
(3)CH3OH��H2��ȼ���ȷֱ�Ϊ����H����725.5kJ/mol����H����285.8kJ/mol��д����ҵ����CO2��H2�ϳ�CH3OH���Ȼ�ѧ����ʽ�� ��
��ȼú�����е�CO2ת��Ϊ���ѵķ�Ӧԭ��Ϊ��
2CO2(g) + 6H2(g) CH3OCH3(g)
+ 3H2O(g)
CH3OCH3(g)
+ 3H2O(g)
��֪һ��ѹǿ�£��÷�Ӧ�ڲ�ͬ�¶ȡ���ͬͶ�ϱ�ʱ��CO2��ת���ʼ��±���
|
Ͷ�ϱ�[n(H2) / n(CO2)] |
500 K |
600 K |
700 K |
800 K |
|
1.5 |
45% |
33% |
20% |
12% |
|
2.0 |
60% |
43% |
28% |
15% |
|
3.0 |
83% |
62% |
37% |
22% |
(4)�÷�Ӧ���ʱ���H 0���ر���S___0�����������
(5)�ü�����Ϊȼ�ϵ��ԭ�ϣ��ڼ��Խ����иõ�ظ����ĵ缫��Ӧʽ ������1.12 L��min-1����״������������õ����ͨ����ѣ��е�Ϊ-24.9 �棩���øõ�ص��500 mL 2 mol��L-1 CuSO4��Һ��ͨ��0.50 min�������Ͽ���������ͭ g��
�� �����ڷ�ֹ����ЧӦ
��
HOCH2CH2NH2 �� H2O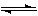 HOCH2CH2NH3���� OH��]
HOCH2CH2NH3���� OH��]
�� CO2(g)��3H2(g)��CH3OH(l)��H2O(l) ��H����131.9kJ/mol��3�֣�
(4) ����1�֣�������1�֣� ��5��CH3OCH3 ��12e�� ��16OH����2CO32�� ��11H2O
(6)9.6��3�֣�
����������HOCH2CH2NH2 �е�-NH2Ϊ���Ի��ţ��ܽ��ˮ�������H+��ʹˮ�ĵ���ƽ�������ƶ���OH-Ũ����������Һ��C��H+����C��OH-�������Ҵ���ˮ��Һ�������ԣ�
��3�������⣬�������Ȼ�ѧ����ʽ��
CH3OH��l��+3/2O2(g) ��CO2(g)+2H2O(l) ��H����725.5kJ/mol ��
H2(g)+1/2 O2(g)��H2O(l) ��H����285.8kJ/mol ��
�ڡ�3-�٣��ã�CO2(g)��3H2(g)��CH3OH(l)��H2O(l) ��H����131.9kJ/mol
��4�����ñ����е���ͬһ�������ݷ������¶�Խ�ߣ�CO2��ת����ԽС�������£�ƽ�������ƶ�����˵������Ϊ���ȷ�Ӧ��������Ϊ���ȷ�Ӧ����H��0��
��ֵ��ʾ��ϵ�Ļ��Ҷȣ��÷�Ӧ���ɷ�Ӧ�ﵽ����������������С��2+8�䵽1+3��������ϵ�Ļ��Ҷȼ�С����S��0��
��5���ڼ���ȼ�ϵ���У��������ѵ�ȼ�շ�Ӧ�����ڸ÷�Ӧ�м���ʧ��������ԭ�������ڼ��Խ����и����ĵ缫��ӦʽΪCH3OCH3 ��12e�� ��16OH����2CO32�� ��11H2O �٣�
�ü���ȼ�ϵ������Դ�����CuSO4��Һʱ����·�е���غ㣬��
Cu2++2e-=Cu ��
�ɢ٢ڣ��ã�CH3OCH3 ��12e���� 6 Cu
1 6
(1.12 L��min-1��0.50 min)/22.4L.mol-1
=0.025 mol n(Cu)
��n(Cu)= 0.025 mol��6=0.15 mol��m(Cu)= 0.15 mol��64g/mol=9.6g��


 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
������A�����ϣ��������������֪����Է�������Ϊ136������ʽC8H8O2��A������ֻ��һ�������ұ�����ֻ��һ��ȡ��������˴Ź�����������������ͼ������A������˵���У�����ȷ���ǿ���]
A��A����������������һ���������ܷ���ˮ�ⷴӦ
B��A��һ�������¿���3mol H2�����ӳɷ�Ӧ
C����������A���ӽṹ�������л���ֻ��һ��
D����A����ͬ������ͬ���칹��ֻ��2��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2010-2011ѧ�꽭��ʡ�����������и������в��ԣ�һ����ѧ�Ծ� ���ͣ������
��10�֣���������������ֹʹ�������á��״��������ڦ�-Al2O3�������������ɼ����ѣ�CH3��S��CH3��������������NO2��Ӧ��ȡ�������� ( )���йط�Ӧ���£�
)���йط�Ӧ���£�
��Ӧ�� 2CH3OH(l)��H2S(g)��(CH3)2S(l) ��2H2O(l) ��H���DakJ��mol-1
��Ӧ�� (CH3)2S(l)��NO2(g)��(CH3)2SO(l)��NO(g) ��H����bkJ����mol-1
��Ӧ�� 2NO(g)��O2(g)��2NO2(g) ��H����ckJ��mol-1
��1��д���ü�����ֱ�Ӻ�������Ӧ��ȡ�����������Ȼ�ѧ��Ӧ����ʽ
___________________________________________________��
 ��2����˵����Ӧ2CH3OH(l)��H2S(g)
(CH3)2S(l) ��2H2O(l)��ƽ��״̬����____________
��
��2����˵����Ӧ2CH3OH(l)��H2S(g)
(CH3)2S(l) ��2H2O(l)��ƽ��״̬����____________
��
A. v(CH3OH) = 2v(H2S)
B. ���������У���ϵ��ѹǿ���ٸı�
C. ���������У���ϵ��������ܶȲ��ٸı�
D. ���������У������Ħ���������ٸı�
��3����Ӧ����һ�������¿ɴﵽƽ�⣬��������¸÷�Ӧƽ�ⳣ������ʽK= ____________________��
��4��N2O5��һ��������ɫ�����������Ʊ��������������֡�
����һ��4NO2(g)��O2(g) ��2N2O5(g)�� ��H����56.76 KJ��mol-1 [��Դ:ѧ#��#��Z#X#X#K]
�����£��÷�Ӧ�������Է����У�������Ӧ�ġ�S __________ 0�����������������
�������������⻯��ȼ�ϵ������Դ�����õ�ⷨ�Ʊ��õ�N2O5������ԭ������ͼ��

���⻯��ȼ�ϵ�ص�������Ӧʽ________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2013���㽭ʡ���ݰ�У�߶���ѧ����ĩ������ѧ�Ծ� ���ͣ������
��14�֣�ij�л����A��Ϊͬ���칹�壬���ⶨ���ǵ���Է�������С��100����1mol����O2�г��ȼ�յõ������ʵ�����CO2��H2O ��ͬʱ����112LO2����״�����������������½�1 mol����ȫˮ���������1 mol �� ��1mol�� ��������һ�������£������Ա�����������Ϊ�ҡ�

��������ײⶨ��A�Ľṹ�д���C��O˫����C��O�������������в����� �ṹ�Ļ��ţ�B��HIO4���ڲ�����ʱֻ����һ�ֲ���C������Ϊ����ط�Ӧ����Ϣ��ת����ϵ��
�ṹ�Ļ��ţ�B��HIO4���ڲ�����ʱֻ����һ�ֲ���C������Ϊ����ط�Ӧ����Ϣ��ת����ϵ��

�� ��ȷ����д���ķ���ʽ ��
д����������������ͬ���칹��Ľṹ��ʽ ��
�����ͬ�� ���ܷ���Ӧ������Ӧ[��Դ:ѧ#��#��]
�� E �� F �ķ�Ӧ����Ϊ ��Ӧ��[��Դ:Z|xx|k.Com]
�� A�Ľṹ��ʽΪ ��G �Ľṹ��ʽΪ ��
�� B ��D�ķ�Ӧ��ѧ����ʽΪ ��
��д��C��Ag(NH3)2OH��Ӧ�Ļ�ѧ����ʽ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2010���㽭ʡ�߶���ѧ�����п��Ի�ѧ���� ���ͣ�ѡ����
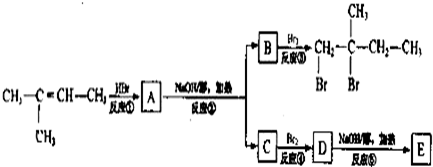
���з�Ӧ�IJ����У��е���ͬ���칹�壬�е�û��ͬ���칹�壬����һ��������ͬ���칹��ķ�Ӧ�� ( )
A�������ϩ[ CH2=C(CH3)CH=CH2 ]������ʵ�����Br2�����ӳɷ�Ӧ
B��2-�ȶ���(CH3CH2CHClCH3)��NaOH�Ҵ���Һ���ȷ�����ȥHCl���ӵķ�Ӧ
C���ױ���һ�������·�����������һ�����ױ��ķ�Ӧ[��Դ:ѧ*��*��Z*X*X*K]
D�����ǻ���������NaHCO3��Һ��Ӧ
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com