
【题目】Y、Z、W、R、M五种元素,位于元素周期表的前四周期,它们的核电荷数依次增大,有如下信息:
元素 | 相关信息 |
Y | 原子核外有6个不同运动状态的电子 |
Z | 非金属元素,基态原子的s轨道的电子总数与p轨道的电子总数相同 |
W | 主族元素,与Z原子的价电子数相同 |
R | 价层电子排布式为3d64s2 |
M | 位于第ⅠB族,其被称作“电器工业的主角” |
请回答下列问题(Y、Z、W、R、M用所对应的元素符号表示):
(1)Z、W元素相比,第一电离能较大的是____,M2+的核外电子排布式为_______。
(2)M2Z的熔点比M2W的______(填“高”或“低”),请解释原因:_____________。
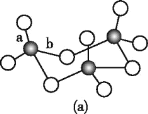
(3)WZ2的VSEPR模型名称为______;WZ3气态为单分子,该分子中W原子的杂化轨道类型为____;WZ3的三聚体环状结构如图(a)所示,该结构的分子中含有____个σ键;写出一种与WZ3互为等电子体的分子的化学式_____。
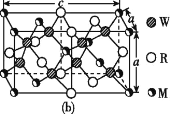
(4)MRW2的晶胞如图(b)所示,晶胞参数a=0.524 nm、c=1.032 nm;MRW2的晶胞中,晶体密度ρ=____g/cm3(只要求列算式,不必计算出数值,阿伏加德罗常数为NA=6.02×1023 mol-1)。
【答案】O [Ar]3d9或1s22s22p63s23p63d9 高 氧离子半径比硫离子半径小,Cu2O比Cu2S的晶格能大,所以Cu2O熔点高 平面三角形 sp2 12 BF3等 ![]()
【解析】
Y、Z、W、R、M五种元素,位于元素周期表的前四周期,它们的核电荷数依次增大。Y的原子核外有6个不同运动状态的电子,Y为C元素; Z是非金属元素,基态原子的s轨道的电子总数与p轨道的电子总数相同,Z的电子排布式为1s2s22p4,Z为O元素;W是主族元素,与Z原子的价电子数相同,W为S元素;R的价层电子排布式为3d64s2, R为Fe元素;M位于第IB族,其被称作“电器工业的主角”,为Cu元素,据此分析结合元素性质解答。
(1) Z为O元素,W为S元素,同一主族,从上到下,第一电离能逐渐减小,O和S元素相比,第一电离能较大的是O,M为Cu元素,Cu2+的核外电子排布式为[Ar]3d9或1s22s22p63s23p63d9;
(2) M为Cu元素,Z为O元素,W为S元素,M2Z为Cu2O,M2W为Cu2S,由于氧离子的半径小于硫离子的半径,则Cu2O比Cu2S的晶格能大,所以Cu2O的熔点比Cu2S的高;
(3) W为S元素,Z为O元素,WZ2为SO2,中心原子S价层电子对数=2+![]() =3,S原子采取sp2杂化,VSEPR模型名称为平面三角形;SO3气态为单分子,该分子中S原子的价层电子对数=3+
=3,S原子采取sp2杂化,VSEPR模型名称为平面三角形;SO3气态为单分子,该分子中S原子的价层电子对数=3+![]() =3,杂化轨道类型为sp2;单键都为σ键,SO3的三聚体环状结构如图(a)所示,该结构的分子中含有12个σ键,SO3由4个原子构成,价电子总数为24,与SO3互为等电子体的分子的化学式为BF3;
=3,杂化轨道类型为sp2;单键都为σ键,SO3的三聚体环状结构如图(a)所示,该结构的分子中含有12个σ键,SO3由4个原子构成,价电子总数为24,与SO3互为等电子体的分子的化学式为BF3;
(4)MRW2为CuFeS2,晶胞中每个Cu原子与4个S原子相连,CuFeS2的晶胞中S原子个数=8、Fe原子个数=4×![]() +4×
+4×![]() +2×
+2×![]() =4、Cu原子个数=8×
=4、Cu原子个数=8×![]() +4×
+4×![]() +1=4,晶胞体积=a2c=(0.524×10-7×0.524×10-7×1.032×10-7)cm3,晶体密度ρ=
+1=4,晶胞体积=a2c=(0.524×10-7×0.524×10-7×1.032×10-7)cm3,晶体密度ρ=![]() =
=![]() =
=![]() g/cm3=
g/cm3=![]() g/cm3。
g/cm3。


科目:高中化学 来源: 题型:
【题目】高温下,Fe2O3和H2反应可转化为Fe3O4,方程式为3Fe2O3+H2![]() 2Fe3O4+H2O。下列说法正确的是( )
2Fe3O4+H2O。下列说法正确的是( )
A.Fe2O3俗名磁性氧化铁
B.该反应条件下H2的还原性强于Fe3O4的还原性
C.每消耗160 g Fe2O3,反应中转移2×6.02×1023个电子
D.Fe3O4可由Fe与H2O在常温下反应制得
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(题文)亚氯酸钠(NaClO2)是重要漂白剂。探究小组开展如下实验,回答下列问题:
实验Ⅰ:制取NaClO2晶体按右图装置进行制取。

A B C D E
已知:NaClO2饱和溶液在低于38℃时析出NaClO23H2O,38-60℃时析出NaClO2,高于60℃时NaClO2分解成NaClO3和NaCl。
(1)用50%双氧水配制30%的H2O2溶液,需要的玻璃仪器除玻璃棒、胶头滴管、烧杯外,还需要_____(填仪器名称);装置C的作用是_____________________。
(2)B中产生ClO2的化学方程式______________________________________。
(3)装置D中反应生成NaClO2的化学方程式为____________________________ 。反应后的溶液中阴离子除了ClO2-、ClO3-、Cl-、ClO-、OH—外还可能含有的一种阴离子是_________,检验该离子的方法是___________________________。
(4)请补充从装置D反应后的溶液中获得NaClO2晶体的操作步骤。
①减压,55℃蒸发结晶;②______________;③______________;④______________;得到成品。
(5)如果撤去D中的冷水浴,可能导致产品中混有的杂质是______________;
实验Ⅱ:样品杂质分析与纯度测定
(6)测定样品中NaClO2的纯度。测定时进行如下实验:
准确称一定质量的样品,加入适量蒸馏水和过量的KI晶体,在酸性条件下发生如下反应:ClO2-+ 4I-+4H+ =2H2O+2I2+Cl-,将所得混合液稀释成100mL待测溶液。
取25.00mL待测溶液,加入淀粉溶液做指示剂,用c mol·L-1 Na2S2O3标准液滴定至终点,测得消耗标准溶液体积的平均值为V mL(已知:I2 +2S2O32-=2I-+S4O62-)。
①确认滴定终点的现象是__________________________________________________。
②所称取的样品中NaClO2的物质的量为______________mol(用含c、V的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化还原反应实际上包含氧化和还原两个过程。下面是一个还原过程的反应式:NO3-+4H++3e-=NO↑+2H2O,KMnO4、Na2CO3、Cu2O、FeSO4四种物质中有物质(甲)能使上述还原过程发生。则下列说法中正确的是
A. 在上述反应中,电子从氧化剂转移到还原剂
B. 物质甲可能是KMnO4
C. 反应中若产生3.0g气体,则转移电子数约为0.3×6.02×1023
D. 氧化过程的反应式一定为Cu2O-2e-+2H+=2Cu2++H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁是人类较早使用的金属之一,铁及其化合物之间的相互转化作用可用下式表示:
![]()
I.回答下列有关问题:
(1)向沸水中逐滴滴加1mol/LFeCl3溶液,至液体呈透明的红褐色,形成该分散系的微粒大小范围是______nm。
(2)电子工业需用30%的FeCl3溶液腐蚀敷在绝缘板上的铜,生成FeCl2和CuCl2,制造印刷电路板。写出FeCl3溶液腐蚀铜的化学反应方程式:___________。检验反应后溶液中还存在Fe3+的试剂是__________。
(3)在下列化学方程式中:2Fe(OH)3+3NaClO+4NaOH=2Na2FeO4+3NaCl+5H2O还原剂是______,生成1molNa2FeO4转移电子数目为__________。
II.现有五种溶液,分别含下列离子:①Ag+,②Mg2+,③Fe2+,④Al3+,⑤Fe3+。
(1)写出符合下列条件的离子符号:既能被氧化又能被还原的离子是______,加铁粉后溶液增重的是______;
(2)向Fe2+的溶液中滴加NaOH溶液,现象是___________________。
(3)欲除去FeCl2中FeCl3选用合适的试剂和分离方法,并写出相应离子方程式:__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】羰基硫(COS)可作为一种粮食熏蒸剂,能防止某些昆虫、线虫和真菌的危害。在恒容密闭容器中,将CO和H2S混合加热并达到下列平衡:
CO(g)+H2S(g)![]() COS(g)+H2(g) K=0.1
COS(g)+H2(g) K=0.1
反应前CO物质的量为10mol,平衡后CO物质的量为8mol。下列说法正确的是
A. 升高温度,H2S浓度增加,表明该反应是吸热反应
B. 通入CO后,正反应速率逐渐增大
C. 反应前H2S物质的量为7mol
D. CO的平衡转化率为80%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列有关叙述不正确的是
A.乙烯和环丁烷(C4H8)的混合气体共28g含有的原子数目为6NA
B.0.1 mol羟基中所含有的电子数为NA
C.1 L0.1 mol·L-1 Na2S溶液中,S2-、 HS-和H2S的微粒数之和为0.1NA
D.在K37C1O3+6H35Cl(浓)=KCl+3Cl2↑+3H2O反应中,若反应中电子转移的数目为10NA则有424g氯气生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素![]() 、
、![]() 、
、![]() 、
、![]() 的原子序数依次增大,
的原子序数依次增大,![]() 的最高正价与最低负价代数和为0,
的最高正价与最低负价代数和为0,![]() 、
、![]() 、
、![]() 形成的化合物甲的结构如图所示,
形成的化合物甲的结构如图所示,![]() 在同周期中原子半径最小。下列说法正确的是( )
在同周期中原子半径最小。下列说法正确的是( )
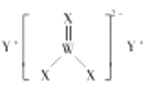
A.原子半径大小:![]()
B.电负性大小:![]()
C.![]() 、
、![]() 形成的化合物为离子化合物
形成的化合物为离子化合物
D.化合物甲中阴离子的空间构型为三角锥形
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在指定条件和相应的计量下,甲物质能与乙物质恰好都能完全反应的是
选项 | 甲 | 乙 | 条件 |
A | 1L0.4 mol·L-1氨水 | 含0.12molAlCl3的AlCl3溶液 | 常温常压 |
B | 0.9g Al | 50 mL18.4 mol·L-1H2SO4溶液 | 常温 |
C | 2.24L SO2 | 含0.1molNaOH的NaOH溶液 | 标准状况 |
D | 1mL Cl2 | 5mL H2O | 常温、避光 |
A.AB.BC.CD.D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com