
【题目】如图,从A处通入纯净的Cl2,打开B阀时,C处的红色布条上看不到明显现象;当关闭B阀后,C处红布逐渐褪色,则D瓶中装的是( )

A. 浓H2SO4 B. NaOH溶液 C. Na2SO3溶液 D. 饱和NaCl溶液
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】(1)氯化铵的水溶液显弱酸性,其原因为___________________(用离子方程式表示),0.1 molL-1的氨水中加入少量的NH4Cl固体,溶液的pH________(填“升高”或“降低”);若加入少量的明矾,溶液中的NH4+的浓度__________(填“增大”或“减小”);
(2)25℃,两种酸的电离平衡常数如下表。
化学式 | CH3COOH | H2CO3 | HCN | HClO | H2SO3 |
电离常数 | 1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | 5×10-10 | 3.0×10-8 | K1=2×10-2 K2=1×10-7 |
①物质的量浓度均为0.1 mol/L的四种溶液:
a.CH3COONa b.Na2CO3 c.NaClO d.NaHCO3
pH由大到小的顺序为__________(用编号填写)。
②根据上表数据判断,下列离子方程式错误的是__________。
A.CO2(过量)+H2O+ClO-=HCO3-+HClO B.SO2(过量)+H2O+ClO-=HSO3-+HClO
C.CO2(少量)+H2O+CN-=HCO3-+HCN D.SO2(少量)+H2O+CN-=HSO3-+HCN
E.SO2(少量)+2CO32-+H2O=SO32-+2HCO3- F.2SO2(过量)+CO32-+H2O=2HSO3-+CO2↑
③0.10 molL-1Na2SO3溶液中离子浓度由大到小的顺序为___________________。
④25℃时,NaCN与HCN的混合溶液,若c(CN-)=c(HCN),则溶液中pH=__________(已知lg2=0.3,lg5=0.7)。
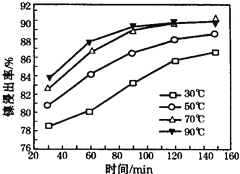
⑤25℃时,若向NaHSO3溶液中加入少量的I2,则溶液中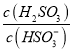 将__________(填“增大”“减小”或“不变”)。
将__________(填“增大”“减小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】醋酸镍[(CH3COO)2Ni]是一种重要的化工原料。一种以含镍废料(含NiS、Al2O3、FeO、CaO、SiO2)为原料,制取醋酸镍的工艺流程图如下:

相关离子生成氢氧化物的pH和相关物质的溶解性如下表:
金属离子 | 开始沉淀pH | 沉淀完全pH | 物质 | 20℃溶解性(H2O) | |
Fe3+ | 1.1 | 3.2 | CaSO4 | 微溶 | |
Fe2+ | 5.8 | 8.8 | NiF2 | 可溶 | |
Al3+ | 3.0 | 5.0 | CaF2 | 难溶 | |
Ni2+ | 6.7 | 9.5 | NiCO3 | Ksp=9.6×10-6 |
(1)将粉碎的含镍废料酸浸时要不断搅拌,粉碎和搅拌的目的是________________。
(2)调节pH步骤中,溶液pH的调节范围是__________________________________。
(3)滤渣1和滤渣3主要成分的化学式分别是________________,_____________。
(4)氧化步骤中加入H2O2发生反应的离子方程式为____________________________。
(5)酸浸过程中,lmol NiS失去6NA个电子,同时生成两种无色有毒气体。该反应的化学方程式为____________________。
(6)保持其他条件不变,在不同温度下对含镍废料进行酸浸,镍浸出率随时间变化如右图。酸浸的最佳温度与时间分别为:
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】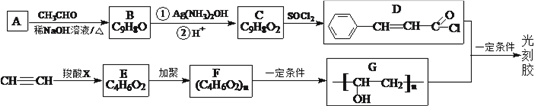
己知: 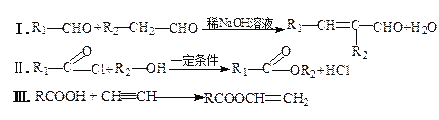
请回答下列问题:
(1)A的名称是_____________。E中所含官能团的名称是________________。
(2)C→D的反应类型是_____________,X的结构简式为________________。
(3)D +G→光刻胶的化学方程式为_____________________________________。
(4)T是C的同分异构体,T具有下列性质或特征:①能发生水解反应和银镜反应;②能使溴水褪色;③属于芳香族化合物。则T的结构有___________种,其中核磁共振氢谱为5组峰,且峰面积比为1:1:2:2:2的结构简式为______________(已知:C=C—OH不稳定)。
(5)根据自己已学知识并结合相关信息,写出以CH3CH2OH为原料制备CH3CH2CH2COOH的合成路线流程图(无机试剂任选)___________________。(合成路线流程图示例:CH2 =CH2![]() CH3CH2Br
CH3CH2Br![]() CH3CH2OH)
CH3CH2OH)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(题文)为了探究三种气态氧化物(SO2、NO2、CO2)的性质,某同学设计了一组实验:
(1)实验一:探究三种气体在水中的溶解性,用三支相同的试管收集满三种气体,倒置在盛满水的烧杯中,一段时间后,观察到的现象如图A,B,C所示。
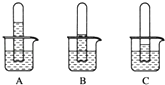
(i)在相同条件下,三种气体在水中溶解度最大的是_____,写出A烧杯中发生反应的化学方程式:________。
(2)实验二:用三只集气瓶收集满二氧化硫、二氧化氮气体,然后将其倒置在水槽中.分别缓慢通入适量O2或Cl2,如图D,E,F所示.一段时间后,D,E装置的集气瓶中充满溶液,F装置的集气瓶中还有气体剩余。
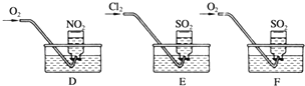
(ii)实验二中装置D的集气瓶最终充满溶液(假设瓶内液体不扩散):
①写出装置D中总反应的化学方程式:________。
②假设该实验条件下,气体摩尔体积为aLmol﹣1,则装置D的集气瓶中所得溶液溶质的物质的量浓度为_____。
(iii)实验前在F装置的水槽里滴加几滴紫色石蕊试液,观察到的现象是________,通入氧气后,可能观察到的实验现象是________,写出反应的化学方程式:________。
(iv)溶液充满集气瓶后,在E装置的水槽里滴加硝酸钡溶液,写出有关反应的离子方程式________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“纳米材料”是粒子直径为1~100 nm之间的材料,纳米碳就是其中的一种。某研究所将纳米碳均匀地分散入蒸馏水中,得到的物质()
①是溶液 ②是胶体 ③具有丁达尔效应 ④能透过滤纸 ⑤静置会立即形成沉淀
A.②③④B.②③⑤C.①④⑤D.①③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属铝在生产生活中有广泛用途。
(1)铝元素在元素周期表中位于______________。
(2)用化学方程式表示工业制备铝单质______________。 铝热反应可用于焊接钢轨,下图为铝热反应的实验装置图。

(3) 该铝热反应的化学方程式是______________。铝热反应的反应现象说明反应物的总能量___________生成物的总能量(填“<”、“>”或“=”)。
(4)铝热反应在工业上用于冶炼______________金属(填编号)。
A. 强还原性 B. 难熔性 C. 易导电 D. 活泼
(5)反应结束后,从沙中取出生成的固体物质,有同学推测该固体是铁铝合金,他设计了如下实验证明此 固体中含有金属铝:取少量固体于试管中,滴加______________,当观察到______________现象时,证明固体中含有金属铝。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:一定温度下的某恒容密闭容器中仅发生反应:2NO2(g) ![]() 2NO(g) + O2(g) △H =+Q kJ/mol (Q>0) 。若向2L该容器中通入1.2 mol NO2 气体,测得100s时反应达到化学平衡状态,此时c(O2) 为0.2 mol/L。下列说法正确的是
2NO(g) + O2(g) △H =+Q kJ/mol (Q>0) 。若向2L该容器中通入1.2 mol NO2 气体,测得100s时反应达到化学平衡状态,此时c(O2) 为0.2 mol/L。下列说法正确的是
A. 增加c(NO),平衡逆向移动,反应的化学平衡常数减小
B. 100s 内NO2的分解速率为8×10-3 mol/(L·s)
C. 反应达平衡时,吸收的热量为0.2Q
D. 其他条件不变时,若开始时n(NO2)为2.4 mol,则达到平衡后,c(O2)<c(NO2)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com