
【题目】准确称取6.0 g铝土矿样品(主要成分为Al2O3,含Fe2O3杂质),加入100 mL稀硫酸中,充分反应后向滤液中加入10 mol·L-1NaOH溶液,产生沉淀的质量和加入NaOH溶液体积之间的关系如图所示。则所用硫酸物质的量浓度为( )

A. 3.50 mol·L-1
B. 1.75 mol·L-1
C. 0.85 mol·L-1
D. 无法确定
【答案】B
【解析】图像中前期加入的NaOH没有在溶液中生成沉淀说明溶解铝土矿时H2SO4过量,所以6.0g铝土矿溶解后得到Al2(SO4)3\、Fe2(SO4)3、H2SO4混合溶液,加入NaOH溶液后反应依次为:H2SO4+2NaOH=Na2SO4+2H2O、Fe2(SO4)3+6NaOH=2Fe(OH)3↓+3Na2SO4、Al2(SO4)3+6NaOH=2Al(OH)3↓+3Na2SO4、Al(OH)3+NaOH=NaAlO2+2H2O,当加入35mLNaOH时,沉淀Al(OH)3没有溶解,所以反应后所有的Na元素、SO42-生成Na2SO4,n(H2SO4)=n(Na2SO4)=n(NaOH)/2=10 mol·L-1×0.035L/2=0.175mol,c(H2SO4)=0.175mol/0.1L=1.75mol/L。正确答案B。


科目:高中化学 来源: 题型:
【题目】化学与生产生活密切相关,下列说法不正确的是
A.用食盐、蔗糖等作食品防腐剂
B.用氧化钙作吸氧剂和干燥剂
C.用碳酸钙、碳酸镁和氢氧化铝等作抗酸药
D.用浸泡过高锰酸钾溶液的硅藻土吸收水果产生的乙烯以保鲜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锰酸锂(LiMn2O4)可作为锂离子电池的正极材料.工业上利用软锰矿浆吸收含硫烟气(SO2 和O2)制备锰酸锂,生产流程如图1: 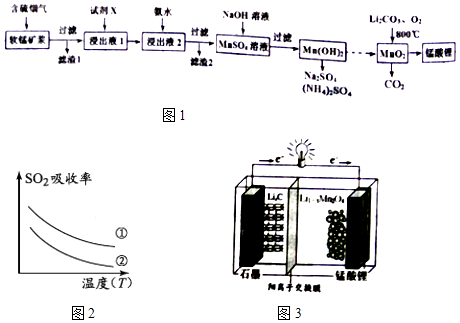
已知:①软锰矿主要成分为MnO2 , 含少量Fe2O3、FeO、Al2O3、SiO2等杂质.
②软锰矿浆在吸收含硫烟气的过程中酸性逐渐增强.
③部分氢氧化物沉淀相关的溶液pH如表一:
沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 | Mn(OH)2 |
开始沉淀 | 2.7 | 7.6 | 3.4 | 7.7 |
完全沉淀 | 3.7 | 9.6 | 4.7 | 9.8 |
(1)已知:(图2)表二 表二
实验序号 | SO2浓度(gm﹣3) | 烟气流速(mLmin﹣1) |
① | 4.1 | 55 |
② | 4.1 | 96 |
下列措施可提高SO2吸收率的是(填序号)
a.降低通入含硫烟气的温度 b.升高通入含硫烟气的温度
c.减少软锰矿浆的进入量 d.减小通入含硫烟气的流速
(2)加入试剂X能提高产品纯度,则X可以是(填化学式)
(3)加氨水调溶液pH在5~6之间,目的是 .
(4)锰酸锂可充电电池(图3)的总反应式为:Li1﹣xMnO4+LixC ![]() LiMnO4+C(x<1) ①放电时,电池的正极反应式为
LiMnO4+C(x<1) ①放电时,电池的正极反应式为
②充电时,若转移1mole﹣ , 则石墨电极将增重g.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验能达到预期目的是( )
A. 用酒精萃取碘水中的碘
B. 用分液法分离花生油和水
C. 海盐经过溶解、过滤、蒸发制纯净的NaCl
D. 将气体通过灼热CuO以除去O2中混有的H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】除去下列物质中的杂质,所用试剂和方法正确的是( )
选项 | 物质 | 杂质 | 除杂质所用试剂和方法 |
A | KCl溶液 | I2 | CCl4,萃取 |
B | KNO3 | K2SO4 | BaCl2溶液,过滤 |
C | Fe | Cu | 稀硫酸,过滤 |
D | CaCO3 | CaO | 稀盐酸,过滤 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ni2O3主要用作陶瓷、搪瓷和玻璃的着色剂,也可用于镍粉的制造.以镍粉废料为原料制备Ni2O3的工艺如图1 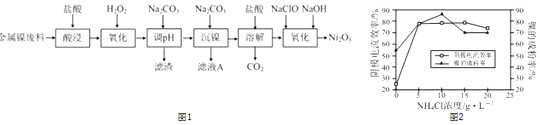
回答下列问题:
(1)Ni2O3中Ni的化合价为 .
(2)提高“酸浸”、“酸溶”速率时,温度不宜过高,其原因是 .
(3)加入H2O2“氧化”的离子方程式为;滤渣A的主要成分是(填化学式).
(4)工艺中分步加入Na2CO3的作用是;为提高原料的利用率,应控制加入NaClO与NaOH的物质的量之比为 .
(5)工业上,用镍为阳极,电解0.1mol/L NiCl2溶液与一定量NH4Cl组成的混合溶液,可得高纯度的球形超细镍粉.当其他条件一定时,NH4Cl的浓度对阴极电流效率(电流效率是指电解时,在电极上实际沉积的物质的量与理论析出量之比)及镍的成粉率的影响如图2所示: ①为获得高纯度的球形超细镍粉,NH4Cl溶液的浓度最好控制为mol/L.
②当NH4Cl溶液的浓度大于15g/L时,阴极有气体生成,导致阴极电流效率降低,请结合平衡移动原理解释其原因: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中发生如下反应:mA(g)+nB(g)pC(g),达到平衡后,保持温度不变,将气体体积缩小到原来的 ![]() ,当达到新平衡时,C的浓度为原来的1.9倍,下列说法正确的是( )
,当达到新平衡时,C的浓度为原来的1.9倍,下列说法正确的是( )
A.m+n>p
B.平衡向逆反应方向移动
C.A的转化率提高
D.C的体积分数增加
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用硫酸酸化的草酸(H2C2O4 , 二元弱酸)溶液能将KMnO4溶液中的MnO4﹣转化为Mn2+ . 某化学小组研究发现,少量MnSO4可对该反应起催化作用.为进一步研究有关因素对该反应速率的影响,探究如下:
(1)常温下,控制KMnO4溶液初始浓度相同,调节不同的初始pH和草酸溶液用量,做对比实验,请完成以下实验设计表.
实验 | 温度 | 初始pH | 0.1mol/L | 0.01mol/L | 蒸馏水 | 待测数据(反应混合液褪色 |
① | 常温 | 1 | 20 | 50 | 30 | t1 |
② | 常温 | 2 | 20 | 50 | 30 | t2 |
③ | 常温 | 2 | 40 | a | b | t3 |
表中a、b的值分别为:a=、b=
(2)该反应的离子方程式 .
(3)若t1<t2 , 则根据实验①和②得到的结论是
(4)请你设计实验④验证MnSO4对该反应起催化作用,完成表中内容.
实验方案(不要求写出具体操作过程) | 预期实验结果和结论 |
若反应混合液褪色时间小于实验①中的t1 , 则MnSO4对该反应起催化作用(若褪色时间相同,则MnSO4对该反应无催化作用) |
(5)某化学小组用滴定法测定KMnO4溶液物质的量浓度:取W g草酸晶体(H2C2O42H2O,其摩尔质量126g/mol)溶于水配成250mL溶液,取25.00mL溶液置于锥形瓶中,加入适量稀H2SO4酸化,再用KMnO4溶液滴定至终点,重复滴定两次,平均消耗KMnO4溶液
V mL.请回答下列问题:
①该测定方法中(填“需要”或“不需要”)加入指示剂;
②计算得KMnO4溶液的c(KMnO4)=mol/L.(请写出最后化简结果)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com