
����Ŀ��(1)���������ʣ��������� ������ ��̼������ ����������
a.�ҳ������ε����ʣ�д������ˮ��Һ�еĵ��뷽��ʽ__________��
b.������������һ���������������ʾ��ܷ�Ӧ����������_________(�����)��
c.д������ϡ���ᷴӦ�����ӷ���ʽ������˫���ű������ת�����________��
(2)�����¼������ʣ���HCl���壬���������Һ����ͭ���ܶ�����̼���ݽ��ʯ�����������ƹ��壬�����ǣ���NaCl���壬�ᰱˮ��������KCl��
�����ܵ������___________________(����ţ���ͬ)��
�������ڵ���ʵ���_________________�����ڷǵ���ʵ���__________________��
(3)д����ҵ���Ʊ�Ư�۵Ļ�ѧ����ʽ_________________________________________��
���𰸡�NaHCO3��Na++HCO3�� �� 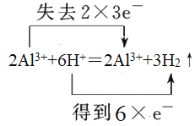 �ڢۢ�� �٢ޢ�� �ܢ� 2Cl2+2Ca(OH)2��CaCl2+Ca(ClO)2+2H2O
�ڢۢ�� �٢ޢ�� �ܢ� 2Cl2+2Ca(OH)2��CaCl2+Ca(ClO)2+2H2O
��������
��1��a.�ɽ��������ӻ�笠����������������ɵĻ��������Σ��ݴ��жϣ�
b.�������ʵ����ʷ����жϣ�
c.����Al��HԪ�صĻ��ϼ۱仯��ϵ��ӵ�ʧ�غ������
��2���������ָ��ˮ��Һ����ۻ�״̬���ܹ�������������ӵĻ�����ǵ������ָ��ˮ��Һ�������״̬�¶�����������������ӵĻ�������������ƶ����ӻ����ӵ����ʿ��Ե��磻
��3��������ʯ���鷴Ӧ�Ʊ�Ư�ۡ�
��1�����������Ǽ���������������Ƕ�Ԫǿ�ᣬ��̼���������������ʽ�Σ�������������һԪǿ���
a.�����ε�������̼�����ƣ���ˮ��Һ�еĵ��뷽��ʽΪNaHCO3��Na++HCO3����
b.������ֻ�������ᷴӦ������������������̼�����ƺ��������Ʒ�Ӧ��̼������ֻ�������ᡢ�������Ʒ�Ӧ������������������һ���������������ʾ��ܷ�Ӧ�������������ᣬ��ѡ�ڡ�
c.�������ᷴӦ��������������������Ԫ�ػ��ϼ۴�0�����ߵ�+3�ۣ�ʧȥ3�����ӣ���Ԫ�ػ��ϼ۴�+1�۽��͵�0�ۣ��õ�1�����ӣ����ݵ��ӵ�ʧ�غ��֪����ת�����Ϊ ��
��
��2����HCl��������ˮ���Ե��磬�ǵ���ʣ�
���������Һ�к��������ƶ����������ӣ��ܵ��磬���ڻ������ǵ����Ҳ���Ƿǵ���ʣ�
��ͭ�ǽ������ʣ��ܵ��磬���ǵ����Ҳ���Ƿǵ���ʣ�
�ܶ�����̼�Ƿǵ���ʣ������磻
�ݽ��ʯ�ǵ��ʣ������磬���ǵ����Ҳ���Ƿǵ���ʣ�
���������ƹ����ǵ���ʣ������磻
�������Ƿǵ���ʣ������磻
��NaCl�����ǵ���ʣ������磻
�ᰱˮ�к��������ƶ����������ӣ��ܵ��磬���ڻ������ǵ����Ҳ���Ƿǵ���ʣ�
������KCl�к��������ƶ������ӣ��ܵ��磬�ǵ���ʡ�
�������ܵ�����Ǣڢۢ�⣻���ڵ���ʵ��Ǣ٢ޢ�⣻���ڷǵ���ʵ��Ǣܢߣ�
��3����ҵ���Ʊ�Ư�۵Ļ�ѧ����ʽΪ2Cl2+2Ca(OH)2��CaCl2+Ca(ClO)2+2H2O��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ϡ�����У�KMnO4��H2O2�ܷ���������ԭ��Ӧ��
������Ӧ��H2O2��2e��===2H++O2��
��ԭ��Ӧ��MnO4-+5e��+8H+===Mn2++4H2O
��1��д����������ԭ��Ӧ����������ʽ��_______________________��
��2����Ӧ����������________��������Ԫ����__________������0.5 mol H2O2�μӴ˷�Ӧ������ת�Ƹ���Ϊ____________��
��3����KMnO4�������㣬��Mn2+�Ĵ������£�H2O2���ֽܷ⣬�ֽⷴӦ�Ļ�ѧ����ʽΪ________________________����ʱ����0.5 mol H2O2�����ֽ⣬����ת�Ƹ���Ϊ__________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ԫ��W��X��Y��Z��ԭ�������������ӣ�p��q��r������ЩԪ����ɵĶ�Ԫ��������m��n�ֱ���Ԫ��Y��Z�ĵ��ʣ�m�dz����Ľ������ʣ�nͨ��Ϊ�����ɫҺ��;0.01mol/Lr��Һ��pHΪ2��p��Ӣ����ѧ�ҷ����ڳ�Ϊ�������̼����������sͨ����������ˮ����ˮ�ص���״Һ�塣�������ʵ�ת����ϵ��ͼ��ʾ������˵���������

A. q����Һ������ B. W�������ﳣ�³�ѹ��ΪҺ̬
C. Z���������ˮ����һ��Ϊǿ�� D. p����ʹ���Ը��������Һ��ɫ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪������ĵ��볣�����£�K(CH3COOH)��1.8��10��5�� K1(H2CO3)��4.4��10��7��K2(H2CO3)��4.7��10��11��K(HClO)��4.0��10��8��
I.��1�������£�0.1mol��L��1������������Һ����CH3COONa��Һ ��Na2CO3��Һ ��NaClO��Һ�� ��pH�ɴ�С��˳����________________������ţ���
��2����NaClO��Һ��ͨ������CO2�����ӷ�Ӧ����ʽΪ___________________________________��
II. �����£���25.00 mL 0.1000 mol��L��1Na2CO3��Һ�еμ�0.1000 mol��L��1���ᣬ��Һ��pH�仯������ͼ��ʾ��
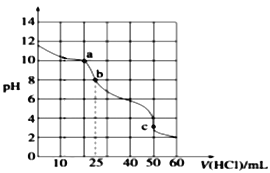
��3��a����Һ��c(CO32��) :c(HCO3��) =______________��
��4��b����Һ������Ϊ______________��b����Һ�ʼ��Ե�ԭ��Ϊ_______________________��
��5��b��c�����е����ӷ�Ӧ����ʽΪ___________________________________________��
III. ����ij̼���ƺ��������ƵĻ����Һ��Ϊ�ⶨ���и��ɷֵ�Ũ�ȣ�ijʵ��С����������·�������������(�����ͼ�ش���������)��
����ȡ20.00mL��Ʒ��Һ����ƿ�У����뼸�η�̪��
����c mol��L��1�ı�������Һ�ζ����յ㣻
���ظ�����ʵ�飬������������ƽ��ֵΪV1 mL��
����ȡ20.00mL��Ʒ��Һ����ƿ�У����뼸�μ��ȣ�
����c mol��L��1�ı�������Һ�ζ����յ㣻
���ظ�����ʵ�飬������������ƽ��ֵΪV2 mL��
��6������������ȡ��Ʒ��Һ��������Ϊ___________________��
��7���������յ�����Ϊ________________________________________________________________��
��8����Ʒ��Һ��̼���ƺ������������ʵ���Ũ��֮��Ϊ___________�����ú�c��V1��V2��ʽ�ӱ�ʾ�������������еζ�����ʱ���Ӷ���������c(Na2CO3)_____��ѡ�ƫ����ƫС��������Ӱ�족����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����б仯���������仯����
A. ��ˮɹ�� B. ú�ĸ��� C. ʪ����ͭ D. ��¯����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ������ij�л���A��ȫȼ�պ�����0.03mol������̼��0.04molˮ�����������ܶ���ͬ��ͬѹ�����������ܶȵ�30����
��1��A�ķ���ʽΪ____________________��
��2�������������ɣ�A��������Ϊ__________��__________����������𣩡�
��3��A��������Ʒ����û���Ӧ����H-NMR����˴Ź�����ͼ��ʾ���������շ壬��д��A��ͭ���±������Ļ�ѧ����ʽ��____________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Ҫ��ش��������⣺
��1����������ӿռ乹��Ϊ____________________��
��2������һ������ʯ�ͻ���ˮƽ�ı�־��__________�������ƣ��IJ�����
��3��2��4��6-�������ױ���TNT���Ľṹ��ʽΪ____________________��
��4����������������������Ȳ���ṹ��ʽΪ____________________��
��5�����ø��������Һ�������__________����ѡ�
a���ѻ����ͺ�ֱ������ b�����ͼױ�
c��˳-2-��ϩ�ͷ�-2-��ϩ d���Ҵ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й������ڻ�ѧ�仯����
A.�������佺����������ЧӦB.���������Ũ���ᷢ���ۻ�
C.ͨ��ʯ�͵ķ����ȡ����D.��������Һ��ʳ��ˮ��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и��������У�����������ԭ��Ӧ�����ܴ���������ǣ�������
A.K+��H+��Fe2+��MnO4��
B.Fe3+��Ba2+��SO42����NO3��
C.Al3+��Na+��SO42����CO32��
D.Fe3+��H+��SO42����ClO��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com