
【题目】下列变化属于物理变化的是
A. 海水晒盐 B. 煤的干馏 C. 湿法炼铜 D. 高炉炼铁
 天天向上口算本系列答案
天天向上口算本系列答案科目:高中化学 来源: 题型:
【题目】硫酸镍晶体(NiSO47H2O)可用于电镀工业,可用含镍废催化剂为原料来制备。已知某化工厂的含镍废催化剂主要含有Ni,还含有Al、Fe的单质及其他不溶杂质(不溶于酸碱)。某小组通过查阅资料,设计了如下图所示的制备流程:

已知: Ksp[Fe(OH)3]=4.0×10-38 ,Ksp[Ni(OH)2]=1.2×10-15
(1)“碱浸”过程中发生反应的离子方程式是_______________________________。
(2)操作a所用到的玻璃仪器有烧杯、________、________;操作c的名称为____________、____________、过滤、洗涤。
(3)固体①是______________;加H2O2的目的是(用离子方程式表示)_____________。
(4)调pH为2-3时所加的酸是________。
(5)操作b为调节溶液的pH,若经过操作b后溶液中c(Ni2+)=2mol·L-1,当铁离子恰好完全沉淀溶液中c(Fe3+)=1.0×10-5mol·L-1时,溶液中是否有Ni(OH)2沉淀生成?________(填“是”或“否”)。
(6)NiSO47H2O可用于制备镍氢电池(NiMH),镍氢电池目前已经成为混合动力汽车的一种主要电池类型.NiMH中的M表示储氢金属或合金.该电池在放电过程中总反应的化学方程式是NiOOH+MH=Ni(OH)2+M,则NiMH电池充电过程中,阳极的电极反应式为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为检验浓硫酸与木炭在加热条件下反应产生SO2和CO2气体,设计了下图实验装置,a、b、c为止水夹,B是用于储气的气囊,D中放有用酸性高锰酸钾溶液浸湿的脱脂棉。

请回答下列问题:
(1)实验前需进行的操作是_______________________________
(2)写出圆底烧瓶中所发生的反应方程式____________________________________________
(3)此实验成败的关键在于控制反应产生气体的速率不能过快,由此设计了虚框部分的装置,则正确的操作顺序是________(用编号填写);
①向A装置中加入浓硫酸,加热,使A中产生的气体进入气囊B,当气囊中充入一定量气体时,停止加热;
②待装置A冷却,且气囊B的体积不再变化后,关闭止水夹a,打开止水夹b,慢慢挤压气囊,使气囊B中气体慢慢进入装置C中,待达到实验目的后,关闭止水夹b;
③打开止水夹a和c,关闭止水夹b;
(4)实验时,装置C中的现象为______________
(5)当D中产生______(用字母填写)现象时,可以说明使E中澄清石灰水变浑的是CO2,而不是SO2;
A.进气口一端脱脂棉紫色变浅,出气口一端脱脂棉紫色不变
B.脱脂棉上紫色均变浅 C.脱脂棉上紫色褪去
则装置D的作用为____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化钙(CaO2)是一种白色晶体,无臭无味,能潮解,难溶于水,可与水缓慢反应;不溶于醇类、乙醚等,易与酸反应,常用作杀菌剂、防腐剂等。通常利用CaCl2在碱性条件下与H2O2反应制得。某化学兴趣小组在实验室制备CaO2的实验方案和装置示意图(图一)如下:


已知:CaO2的制备原理:CaCl2+H2O2+2NH3H2O+6H2O= CaO28H2O↓+2NH4Cl
请回答下列问题:
(1)仪器C的名称为__________,支管B的作用____________;
(2)加入氨水的作用是_______;(从化学平衡移动的原理分析)
(3)过滤后洗涤沉淀的试剂最好用_______;
A.水 B.浓盐酸 C.无水乙醇 D.CaCl2溶液
(4)沉淀反应时常用冰水浴控制温度在O℃左右,其可能原因是_________、_______(写出两种)。
(5)已知CaO2在350℃时能迅速分解,生成CaO和O2。该小组采用如图二所示的装置测定刚才制备的产品中CaO2的纯度(设杂质不分解产生气体)
①检查该装置气密性的方法是:________________;
②准确称取0.50g样品,置于试管中加热使其完全分解,收集到44.80mL(已换算为标准状况)气体,则产品中过氧化钙的质量分数为________(保留4位有效数字);
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴是小组对一种度旧合金(含有Cu、Fe、Si等元素)进行分离、回收利用,所设计工艺流程如下。
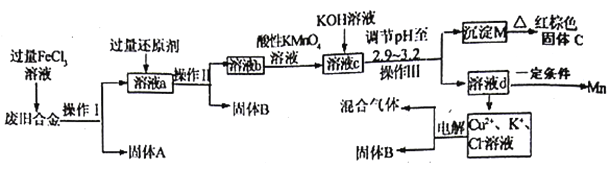
已知298℃时,Ksp[Fe(OH)3]=4.0×10-38,Ksp[Cu(OH)2]=2.2×10-20,Ksp[Mn(OH)2]=1.9×10-13,当离子浓度小于1×10-5认为离子沉淀完全。
回答下列问题:
(1)操作I、lI、III为_______,固体A是__________(填化学式)。
(2)加入过量FeC13溶液过程中与较不活泼的金属反应的化学方程式_______。
(3)调节pH至2.9--3.2的目的___________________。
(4)①向溶液b中加入酸性KMn04溶液发生反应的离子方程式为_________________。
②若将溶液b配制成250ml溶液,用滴定管取配制后的溶液25.00m1;再用amol/LKMnO4溶液滴定,恰好反应时消耗KMn04溶液VmL,则流程图中所得红棕色固体C的质量为___g(用含a、v的代数式表示)
(5)常温下,若溶液c中所含的金属阳离子浓度相等,向溶液c中逐滴加入KOH溶液,最后沉淀的金属离子为____________(填金属阳离子)。
(6)用惰性电极电解(Cu2+、K+、C1-溶液)一段时间后,阴、阳两极均产生标准状况下的气体6.72L,阴极析出固体3.2g,则原溶液C1-的物质的量为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)有四种物质:①氧化铁 ②硫酸 ③碳酸氢钠 ④氢氧化钠
a.找出属于盐的物质,写出其在水溶液中的电离方程式__________。
b.上述物质中有一种与其他三种物质均能反应,此物质是_________(填序号)。
c.写出铝与稀硫酸反应的离子方程式,并用双线桥标出电子转移情况________。
(2)有以下几种物质:①HCl气体,②硝酸钾溶液,③铜,④二氧化碳,⑤金刚石,⑥硫酸氢钠固体,⑦蔗糖,⑧NaCl晶体,⑨氨水,⑩熔融KCl。
以上能导电的是___________________(填序号,下同);
以上属于电解质的是_________________;属于非电解质的是__________________;
(3)写出工业上制备漂白粉的化学方程式_________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
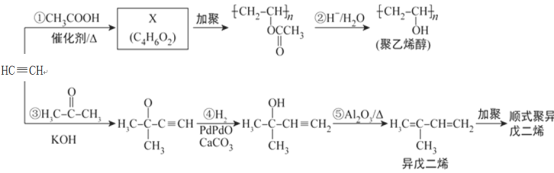
【题目】乙炔是基本有机化工原料,由乙炔制备聚乙烯醇和顺式聚异戊二烯的合成路线(部分反应条件略去)如图所示:
回答下列问题:
(1)按系统命名法命名异戊二烯:________________________________________。
(2)X分子中含有的官能团名称是________________________________________。
(3)反应①~③中,__________(填反应序号)的反应类型与反应④不同,反应⑤属于__________反应。
(4)与乙炔具有相同官能团的异戊二烯的同分异构体共有__________种。
(5)X的所有同分异构体在下列一种表征仪器中显示的信号(或数据)完全相同,该仪器是__________(选填字母)。
a.质谱仪 b.红外光谱仪 c.元素分析仪 d.核磁共振仪
(6)顺式聚异戊二烯的结构式是(选填字母)__________。
a.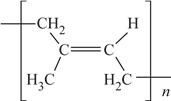 b.
b.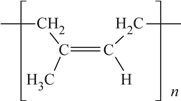
c.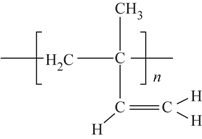 d.
d.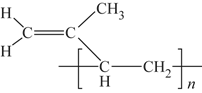
(7)参照异戊二烯的上述合成路线,设计一条由乙烯和乙醛为起始原料制备1,3-丁二烯的合成路线:_________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】欲从含Br-的废液中提取溴单质,需经过一系列操作,实验装置及物质的性质如下:

Br2 | CCl4 | 正十二烷 | |
密度/g·cm-3 | 3. 12 | 1.59 | 0.753 |
沸点/℃ | 58.76 | 76.8 | 215~217 |
下列说法中正确的是
A. 可用装置甲氧化废液中的Br-
B. 装置乙中选用正十二烷而不用CCl4,是因为正十二烷的密度更小
C. 用装置丙进行蒸馏,先收集正十二烷再收集Br2
D. 用装置丁长期贮存液溴
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com