
【题目】过氧化钙(CaO2)是一种白色晶体,无臭无味,能潮解,难溶于水,可与水缓慢反应;不溶于醇类、乙醚等,易与酸反应,常用作杀菌剂、防腐剂等。通常利用CaCl2在碱性条件下与H2O2反应制得。某化学兴趣小组在实验室制备CaO2的实验方案和装置示意图(图一)如下:


已知:CaO2的制备原理:CaCl2+H2O2+2NH3H2O+6H2O= CaO28H2O↓+2NH4Cl
请回答下列问题:
(1)仪器C的名称为__________,支管B的作用____________;
(2)加入氨水的作用是_______;(从化学平衡移动的原理分析)
(3)过滤后洗涤沉淀的试剂最好用_______;
A.水 B.浓盐酸 C.无水乙醇 D.CaCl2溶液
(4)沉淀反应时常用冰水浴控制温度在O℃左右,其可能原因是_________、_______(写出两种)。
(5)已知CaO2在350℃时能迅速分解,生成CaO和O2。该小组采用如图二所示的装置测定刚才制备的产品中CaO2的纯度(设杂质不分解产生气体)
①检查该装置气密性的方法是:________________;
②准确称取0.50g样品,置于试管中加热使其完全分解,收集到44.80mL(已换算为标准状况)气体,则产品中过氧化钙的质量分数为________(保留4位有效数字);
【答案】 恒压滴液漏斗或恒压分液漏斗 平衡气压,便于恒压滴液漏斗中的液体能够顺利滴下 CaCl2+H2O2![]() CaO2+2HCl,加入氨水与氯化氢发生中和反应,使该可逆反应向着生成CaO2的方向移动,提过CaO2的产率 C 防止氨水挥发 防止过氧化氢分解 连接好装置,向水准管中注水至液面与量气管中形成液面差,静置一段时间,若液面差保持不变,则装置不漏气,反之装置漏气 57.60% 或0.5760
CaO2+2HCl,加入氨水与氯化氢发生中和反应,使该可逆反应向着生成CaO2的方向移动,提过CaO2的产率 C 防止氨水挥发 防止过氧化氢分解 连接好装置,向水准管中注水至液面与量气管中形成液面差,静置一段时间,若液面差保持不变,则装置不漏气,反之装置漏气 57.60% 或0.5760
【解析】(1)、C中装的是液态药品,C装置能控制液体的滴加,有支管,所以为恒压滴液漏斗或恒压分液漏斗。支管B的作用是平衡气压,便于恒压滴液漏斗中的液体能够顺利滴下。(2)加入氨水能与氯化氢发生中和反应,使该可逆反应CaCl2+H2O2![]() CaO2+2HCl向着生成CaO2的方向移动,提过CaO2的产率。(3)洗涤沉淀的试剂不能与CaO2反应,A、结合题干知过氧化钙能潮解,难溶于水,可与水缓慢反应,故不选A。 B、结合题干可知过氧化钙易与酸反应,故不选B。C、CaO2不溶于醇类,故选C。D CaCl2溶液中也含有水,结合题干知过氧化钙能潮解,难溶于水,可与水缓慢反应,故不选D。正确选项为C。(4)反应时温度不能过高,温度高氨气就会挥发,过氧化氢就会分解。(5)①检查该装置气密性的方法是:连接好装置,向水准管中注水至液面与量气管中形成高度差,静置一段时间,若高度差不变,则装置不漏气,反之装置漏气。②准确称取
CaO2+2HCl向着生成CaO2的方向移动,提过CaO2的产率。(3)洗涤沉淀的试剂不能与CaO2反应,A、结合题干知过氧化钙能潮解,难溶于水,可与水缓慢反应,故不选A。 B、结合题干可知过氧化钙易与酸反应,故不选B。C、CaO2不溶于醇类,故选C。D CaCl2溶液中也含有水,结合题干知过氧化钙能潮解,难溶于水,可与水缓慢反应,故不选D。正确选项为C。(4)反应时温度不能过高,温度高氨气就会挥发,过氧化氢就会分解。(5)①检查该装置气密性的方法是:连接好装置,向水准管中注水至液面与量气管中形成高度差,静置一段时间,若高度差不变,则装置不漏气,反之装置漏气。②准确称取![]() 样品可以使用分析天平或电子天平或电光天平。收集到标准状况下的气体44.80mL,对应的物质的量为0.0448/22.4=0.002mol,设产品中过氧化钙的物质的量为
样品可以使用分析天平或电子天平或电光天平。收集到标准状况下的气体44.80mL,对应的物质的量为0.0448/22.4=0.002mol,设产品中过氧化钙的物质的量为![]() ,则可列算式:可得:2/x=1/0.002,解得:x=0.004mol,则产品中过氧化钙的质量分数为:0.004×72/0.50=0.576
,则可列算式:可得:2/x=1/0.002,解得:x=0.004mol,则产品中过氧化钙的质量分数为:0.004×72/0.50=0.576
。


 一课一练课时达标系列答案
一课一练课时达标系列答案科目:高中化学 来源: 题型:
【题目】下列说法中正确的悬( )
A.化合物中的原子都是通过共价键相结合的
B.若化学反应吸收能量时,其断键吸收的能量大于成键放出的能量
C.化学反应中,断开化学键要放出能量,形成化学键要吸收能量
D.化学键是构成物质原子间的强相互作用,表现为原子核间的斥力
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将4mol SO2与2 mol O2的混合气分别置于容积相等的甲、乙两容器中,甲是恒压容器,乙是恒容容器。发生反应:2SO2(g)+O2(g)![]() 2SO3(g);△H<0,在相同温度下,使其均达到平衡状态。下列说法正确的是
2SO3(g);△H<0,在相同温度下,使其均达到平衡状态。下列说法正确的是
A. SO3体积分数:甲 > 乙
B. 平衡常数:甲>乙
C. 反应放出的热量:甲<乙
D. 保持容积不变,使乙容器升温可以使甲乙容器中SO2物质的量相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素W、X、Y、Z的原子序数依次增加,p、q、r是由这些元素组成的二元化合物;m、n分别是元素Y、Z的单质,m是常见的金属单质,n通常为深红棕色液体;0.01mol/Lr溶液的pH为2,p被英国科学家法拉第称为“氢的重碳化合物”,s通常是难溶于水、比水重的油状液体。上述物质的转化关系如图所示。下列说法错误的是

A. q的溶液显酸性 B. W的氧化物常温常压下为液态
C. Z的氧化物的水化物一定为强酸 D. p不能使酸性高锰酸钾溶液褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列粒子浓度关系错误的是
A. 0.1 mol·L-1CH3COONa溶液中:c(Na+)>c(OH-)>c(CH3COOH)>c(H+)
B. pH=5的CH3COOH和CH3COONa混合溶液中:c(CH3COO-)>c(Na+)
C. 将0.2mol·L-1CH3COOH溶液与0.1mo1·L-1NaOH溶液等体积混合:c(CH3COO一)+c(CH3COOH) = 2c(Na+)
D. 向0.10mol·L-1NH4HCO3溶液中通入CO2至中性:c(NH4+) = c(HCO3-)+ c(CO32-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知几种酸的电离常数如下:K(CH3COOH)=1.8×10-5; K1(H2CO3)=4.4×10-7;K2(H2CO3)=4.7×10-11;K(HClO)=4.0×10-8。
I.(1)常温下,0.1mol·L-1的下列三种溶液:①CH3COONa溶液 ②Na2CO3溶液 ③NaClO溶液, 其pH由大到小的顺序是________________(填序号);
(2)往NaClO溶液中通入少量CO2的离子反应方程式为___________________________________;
II. 常温下,在25.00 mL 0.1000 mol·L-1Na2CO3溶液中滴加0.1000 mol·L-1盐酸,溶液的pH变化曲线如图所示。
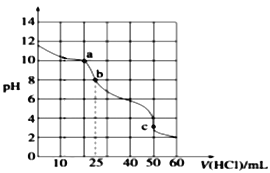
(3)a点溶液中c(CO32-) :c(HCO3-) =______________。
(4)b点溶液中溶质为______________。b点溶液呈碱性的原因为_______________________。
(5)b→c过程中的离子反应方程式为___________________________________________。
III. 现有某碳酸钠和氢氧化钠的混合溶液,为测定其中各成分的浓度,某实验小组设计了如下方案,步骤如下(结合上图回答下列问题):
①量取20.00mL样品溶液于锥形瓶中,加入几滴酚酞;
②用c mol·L-1的标准盐酸溶液滴定至终点;
③重复两次实验,消耗盐酸的体积平均值为V1 mL;
④另取20.00mL样品溶液于锥形瓶中,加入几滴甲基橙;
⑤用c mol·L-1的标准盐酸溶液滴定至终点;
⑥重复两次实验,消耗盐酸的体积平均值为V2 mL;
(6)步骤①中量取样品溶液所用仪器为___________________。
(7)步骤②终点现象为________________________________________________________________。
(8)样品溶液中碳酸钠和氢氧化钠物质的量浓度之比为___________。(用含c、V1、V2的式子表示),若步骤⑥中滴定结束时仰视读数,所得c(Na2CO3)_____(选填“偏大”、“偏小”、“不影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求回答下列问题:
(1)最简单的烃分子空间构型为____________________。
(2)衡量一个国家石油化工水平的标志是__________(填名称)的产量。
(3)2,4,6-三硝基甲苯(TNT)的结构简式为____________________。
(4)经催化加氢后生成异戊烷的炔烃结构简式为____________________。
(5)能用高锰酸钾溶液鉴别的是__________(填选项)
a.裂化汽油和直馏汽油 b.苯和甲苯
c.顺-2-丁烯和反-2-丁烯 d.乙醇和甘油
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com