
【题目】能正确表示下列反应的离子反应方程式为( )
A. Ca(HCO3)2溶液与过量NaOH溶液反应:HCO3- +Ca2++OH-===CaCO3↓+H2O
B. 向明矾溶液中滴加Ba(OH)2溶液,恰好使SO42-沉淀完全:2Al3++3SO42-+3Ba2++6OH -=2Al(OH)3↓+3BaSO4↓
C. 向FeBr2溶液中通入足量氯气:2Fe2++4Br-+3Cl2=2Fe3++2Br2+6Cl-
D. MnO2 与浓盐酸反应制Cl2:MnO2+4HCl=Mn2++2Cl-+Cl2↑+2H2O
【答案】C
【解析】
Ca(HCO3)2溶液与过量NaOH溶液生成碳酸钙和碳酸钠;向明矾溶液中滴加Ba(OH)2溶液,恰好使SO42-沉淀完全,则Ba(OH)2与KAl(SO4)2的比为2:1,Al3+恰好完全生成AlO2-;向FeBr2溶液中通入足量氯气,Fe2+、Br-完全被氧化,生成氯化铁和溴单质;MnO2 与浓盐酸反应制Cl2,浓盐酸需要拆写成离子;
Ca(HCO3)2溶液与过量NaOH溶液生成碳酸钙和碳酸钠,反应离子方程式是2HCO3- +Ca2++2OH-===CaCO3↓+2H2O+ CO32-,故A错误;向明矾溶液中滴加Ba(OH)2溶液,恰好使SO42-沉淀完全,则Ba(OH)2与KAl(SO4)2的比为2:1,Al3+恰好完全生成AlO2-,反应离子方程式是Al3++2SO42-+2Ba2++4OH -= AlO2-+2BaSO4↓+2H2O;向FeBr2溶液中通入足量氯气,生成氯化铁和溴单质,反应离子方程式是2Fe2++4Br-+3Cl2=2Fe3++2Br2+6Cl-,故C正确;MnO2 与浓盐酸反应制Cl2,离子方程式是MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O,故D错误。
Mn2++Cl2↑+2H2O,故D错误。


 轻松夺冠全能掌控卷系列答案
轻松夺冠全能掌控卷系列答案科目:高中化学 来源: 题型:
【题目】足量铜与一定量浓硝酸反应,得到硝酸铜溶液和NO2、N2O4、NO的混合气体,这些气体与1.68 L O2(标准状况)混合后通入水中,所有气体完全被水吸收生成硝酸。若向所得硝酸铜溶液中加入5 mol·L-1氢氧化钠溶液至Cu2+恰好完全沉淀,则消耗NaOH溶液的体积是( )
A. 60 mLB. 45 mLC. 30 mLD. 15 mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知![]() 可以和HClO发生氧化还原反应。某学习小组对氯、硫及其化合物的性质进行下列实验探究活动:
可以和HClO发生氧化还原反应。某学习小组对氯、硫及其化合物的性质进行下列实验探究活动:
实验一:探究亚硫酸与次氯酸的酸性强弱。选用的装置和药品如下。

![]() 装置A气密性检查的方法是________。
装置A气密性检查的方法是________。
![]() 装置连接顺序为A、________、B、E、________、F,其中装置E中反应的离子方程式为________,通过现象________即可证明亚硫酸的酸性强于次氯酸。
装置连接顺序为A、________、B、E、________、F,其中装置E中反应的离子方程式为________,通过现象________即可证明亚硫酸的酸性强于次氯酸。
实验二:探究氯气与硫化氢气体混合能发生反应。选用的装置和药品如下。

![]() 通过现象________即可证明氯气与硫化氢发生了反应。
通过现象________即可证明氯气与硫化氢发生了反应。
![]() 该装置存在一个不妥之处,你的改进措施为________。
该装置存在一个不妥之处,你的改进措施为________。
实验三:探究氯元素和硫元素非金属性强弱。
![]() 为探究氯元素和硫元素的非金属性强弱,下列实验方案或有关说法中正确的是________。
为探究氯元素和硫元素的非金属性强弱,下列实验方案或有关说法中正确的是________。
A.实验一能说明硫元素非金属性强于氯元素 B.实验二能说明硫元素非金属性弱于氯元素
C.通过测定盐酸和氢硫酸的pH来判断非金属性强弱 D.已知硫化氢的沸点为![]() ,氯化氢的沸点为
,氯化氢的沸点为![]() ,则硫元素非金属性强于氯元素
,则硫元素非金属性强于氯元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于纯净物、混合物、电解质、非电解质的正确组合是( )
纯净物 | 混合物 | 电解质 | 非电解质 | |
A | 盐酸 | 冰水混合物 | 硫酸 | 干冰 |
B | 蒸馏水 | 蔗糖溶液 | 氧化铝 | 二氧化硫 |
C | 明矾 | 盐酸 | 铁 | 碳酸钙 |
D | 胆矾 | 食盐水 | 氯化铜 | H2O |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数值。下列有关叙述正确的是( )
A. 14 g乙烯和丙烯混合气体中的碳原子数为2NA
B. 过氧化钠与水反应时,生成0.1mol氧气转移的电子数为0.2NA
C. 1 molFe溶于过量硝酸,电子转移数为2NA
D. lmol FeI2与足量氯气反应时转移的电子数为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四种短周期元素X、Y、Z、W在周期表中的位置如图所示,其中Z元素的最外层电子数是内层电子总数的1/2。下列说法不正确的是( )

A. Z元素位于周期表的第3周期第VA族
B. X的原子半径比Y小
C. Y元素的气态氢化物的热稳定性比Z的高
D. X、W元素的最高价氧化物对应水化物的酸性:W强于X
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把含硫酸铵和硝酸铵的混合液aL分成两等份。一份加入bmolNaOH并加热,恰好把NH3全部赶出;另一份需消耗cmol BaCl2沉淀反应恰好完全,则原溶液中NO3- 的浓度为( )
A. ![]() B.
B. ![]() C.
C. ![]() D.
D. ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学在实验室中设计两个关于NO的探究实验。
(一)工业上在一定温度和催化剂条件下用NH3将NOx还原生成N2,探究NO和NH3能否反应。
(1)氨气的制备

①氨气的发生装置可以选择上图中的_____,反应的化学方程式______________________
②欲收集一瓶干燥的氨气,选择上图中的装置,其连接顺序为:发生装置→__________(按气流方向,用小写字母表示)。
(2)将上述收集到的NH3加入少量催化剂,充入NO,充分混合,冷却到室温,观察到管中有少量水珠,说明NO和NH3能反应,则氧化剂和还原剂的物质的量之比为__________。
(二)探究一氧化氮能否被Na2O2完全吸收,设计了如下实验。装置如下(加热装置省略):

查阅资料所知:①2NO+Na2O22NaNO2
②酸性条件下,NO或NO2都能与KMnO4溶液反应生成NO3 -。
回答下列问题:
(1)仪器a名称:________________ 。
(2)B瓶内装的物质是:_______________ 。
(3)若NO能被Na2O2完全吸收,E装置中的现象为 ______________ 。
(4)三颈烧瓶A中反应的化学方程式为____________________________。
(5)C装置的作用是____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物F(Bisphenol A dimethacrylate)是一种交联单体。合成F的一种路线如下:
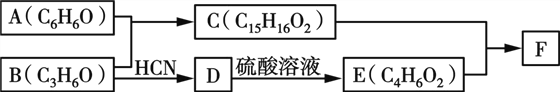
已知:
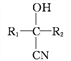
①![]() +HCN
+HCN![]()
②B不能发生银镜反应。
③C能与FeCl3发生显色反应,核磁共振氢谱显示有4种不同化学环境的氢。
④E既能使溴水褪色又能使石蕊试液显红色。
⑤1 mol F最多可与4 mol NaOH反应。
回答下列问题:
(1)A与B反应的化学方程式为________________。
(2)B→D的反应类型为____,E的结构简式为________。
(3)F的结构简式为____________。
(4)C的同分异构体中含有萘环(![]() )结构,萘环上只有1个取代基且水解产物之一能与FeCl3溶液发生显色反应的同分异构体共有____种(不考虑立体异构),其中核磁共振氢谱有8组峰的是____________(写出其中一种的结构简式)。
)结构,萘环上只有1个取代基且水解产物之一能与FeCl3溶液发生显色反应的同分异构体共有____种(不考虑立体异构),其中核磁共振氢谱有8组峰的是____________(写出其中一种的结构简式)。
(5)A经如下步骤可合成环己烯甲酸:
A![]() G
G![]() H
H![]() I
I![]()
![]()
反应条件1为________;反应条件2为______;反应条件3所选择的试剂为____;I的结构简式为____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com